2024年7月18日公開
担当:笹岡俊邦 先生
所属:動物資源開発研究分野
ドーパミン作動性神経伝達は、運動制御、認知、動機付け、学習記憶など広範な役割を持ちます。ヒトの神経疾患のパーキンソン病の運動症状及び運動以外の症状にも、ドーパミン情報伝達が深く関わることが知られています。パーキンソン病の研究の歴史と今後の展望について、本研究所の脳病態解析分野の松井秀彰教授が本脳研コラムにて2回に亘り解説されています(2018年3月18日、2023年5月31日)。
運動制御に影響を与える大脳基底核の主な神経回路として、ドーパミンD1受容体(D1R)を介する直接路、及びドーパミンD2受容体(D2R)を介する間接路が考えられており、運動制御は、直接路と間接路の両方の活動に依存し、直接路は運動を促進し、間接路は運動を抑制すると理解されてきました。そこで、私たちは、D1Rを介するシグナルによる直接路の機能及びD2Rを介するシグナルによる間接路の機能を詳しく理解するため、まず、D1R発現を可逆的に制御できるコンディショナルD1Rノックダウン(D1RcKD)マウスを作製しました[1]。このマウスはテトラサイクリン発現制御システムを用いて、ドキシサイクリン(Dox)投与によりD1R発現を抑制することができ、また、Dox投与を中止するとD1R発現を回復させることができます。このマウスの解析により、D1Rを介するシグナルが、大脳基底核回路の直接路の情報の流れを維持し、運動を促進することを明らかにしました[1](脳研コラム2017年11月29日記事)。
また、ドーパミンシグナルの学習記憶に関する機能として、これまで、報酬学習に関する役割はよく研究されてきましたが、リスク回避の学習、すなわち嫌悪学習における役割はあまり注目されてきませんでした。そこで、私たちは、D1RcKDマウスを用いて、最も単純な形態の嫌悪学習の行動実験を実施し、D1Rシグナルが嫌悪記憶形成に重要であることを明らかにしました。
D1Rを介する情報伝達は、運動機能制御だけでなく、報酬学習並びに嫌悪学習にも寄与している可能性が報告されています[2]。私たちは、D1Rを介するシグナルが嫌悪学習記憶の形成にどう影響するのかについて、D1RcKDマウスを用いて受動的回避試験、文脈的恐怖条件付け試験と聴覚的手がかりの恐怖条件試験を実施しました[3, 4] 。これら3つの嫌悪学習試験は、無条件刺激として電気刺激によるフットショックを与えますが、記憶の形成には、異なる神経回路を必要とすると考えられています。受動的回避試験では、海馬だけでなく、線条体、扁桃体、皮質など複数の領域にも依存するとされています[5-8]。それに対して、文脈的恐怖条件付けは、海馬、扁桃体、線条体及び前頭前野に依存し[9-12]、聴覚的手がかりの恐怖条件付けは、扁桃体または線条体が必要ですが、海馬には依存しないと報告されています[9, 13, 14]。
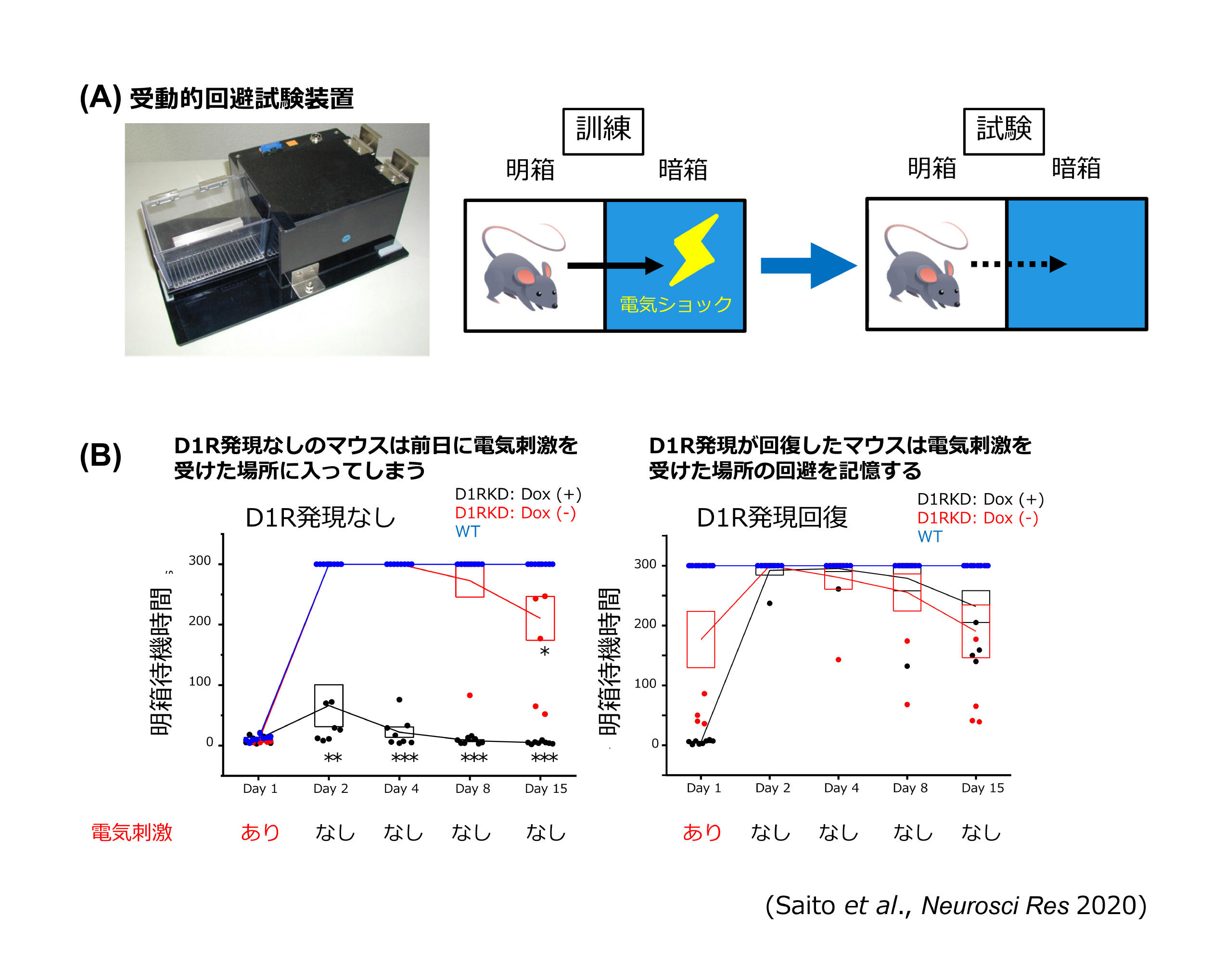
図1 D1ドーパミン受容体を介する情報伝達は受動的回避試験の記憶形成に重要
(B)左パネル:D1R発現なしのマウスは前日に電気刺激を受けた場所に入ってしまう。右パネル:D1R発現が回復したマウスは電気刺激を受けた場所の回避を記憶して明箱に留まる。
まず、受動的回避試験では、成熟期にD1Rの発現を抑制したD1RcKDマウスを用いて解析したところ、近時記憶と遠隔記憶の両方で成績の低下が認められました。さらに同一のD1RcKDマウスでD1R発現が回復した状態では受動的回避試験の成績が回復したことから、D1Rを介した神経伝達が嫌悪記憶形成に重要であることが明らかとなりました(図1)[3]。併せてArc遺伝子発現制御下で蛍光タンパクdVenusを高発現するトランスジェニックマウスとD1RcKDマウスの複合マウスを用いて、受動的回避試験の際のArc発現様式をマウスの全脳透明化と光シート顕微鏡による三次元解析により解析しました。Arcは最初期遺伝子の1つであり、その発現様式は記憶形成中に活性化したニューロンのマーカーとして利用されています[15-17]。その結果、D1R発現抑制による神経伝達障害は、海馬でのArc発現抑制への影響は少なく、大脳皮質においてニューロンの活性化に影響が大きいことがわかりました(図2)。つまり、D1Rを介するシグナルは、大脳皮質におけるArc発現の促進に影響し、大脳皮質ネットワーク内の神経活動を増加させ、嫌悪記憶形成を促進する可能性が示唆されました[3]。
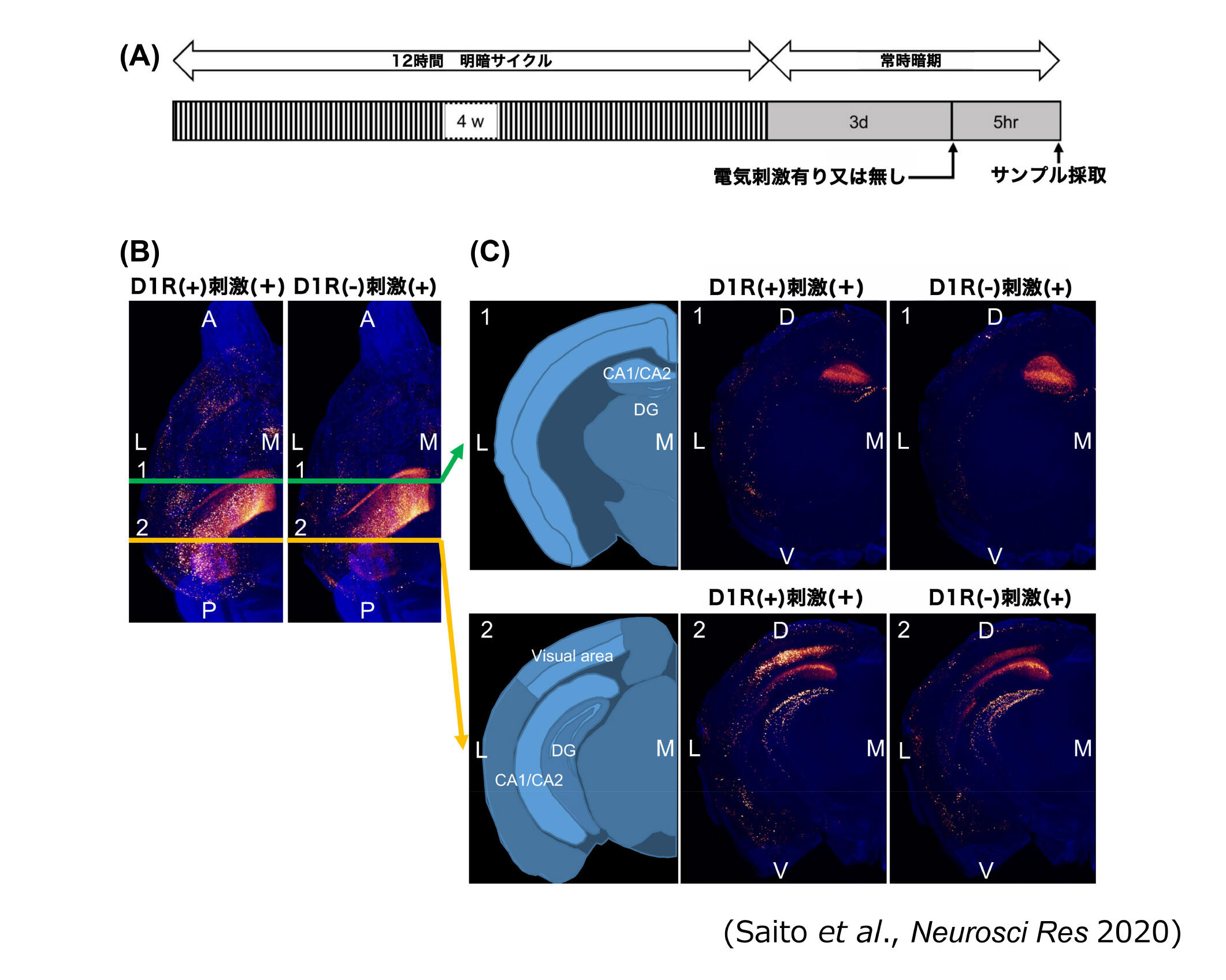
図2 光シート顕微鏡による Arc-dVenus, D1RKDマウス脳の3次元再構成画像
(B)電気刺激を受けたArc-dVenus, D1RKDマウスの3D再構成全脳画像の水平図。左パネル:D1RKD Dox(-)マウスのdVenus信号 右パネル:D1RKD Dox (+)マウスのdVenus信号。核染色は青色。
(C)(B)の全脳画像で1(緑色線)と2(黄色線)で示す位置の再構成画像。左の図は、各脳切片のマップ。 A、前部、P、後部、L、外側、M、内側、D、背側、V、腹側、CA1、海馬CA1領域、CA2、海馬CA2領域、DG、歯状回
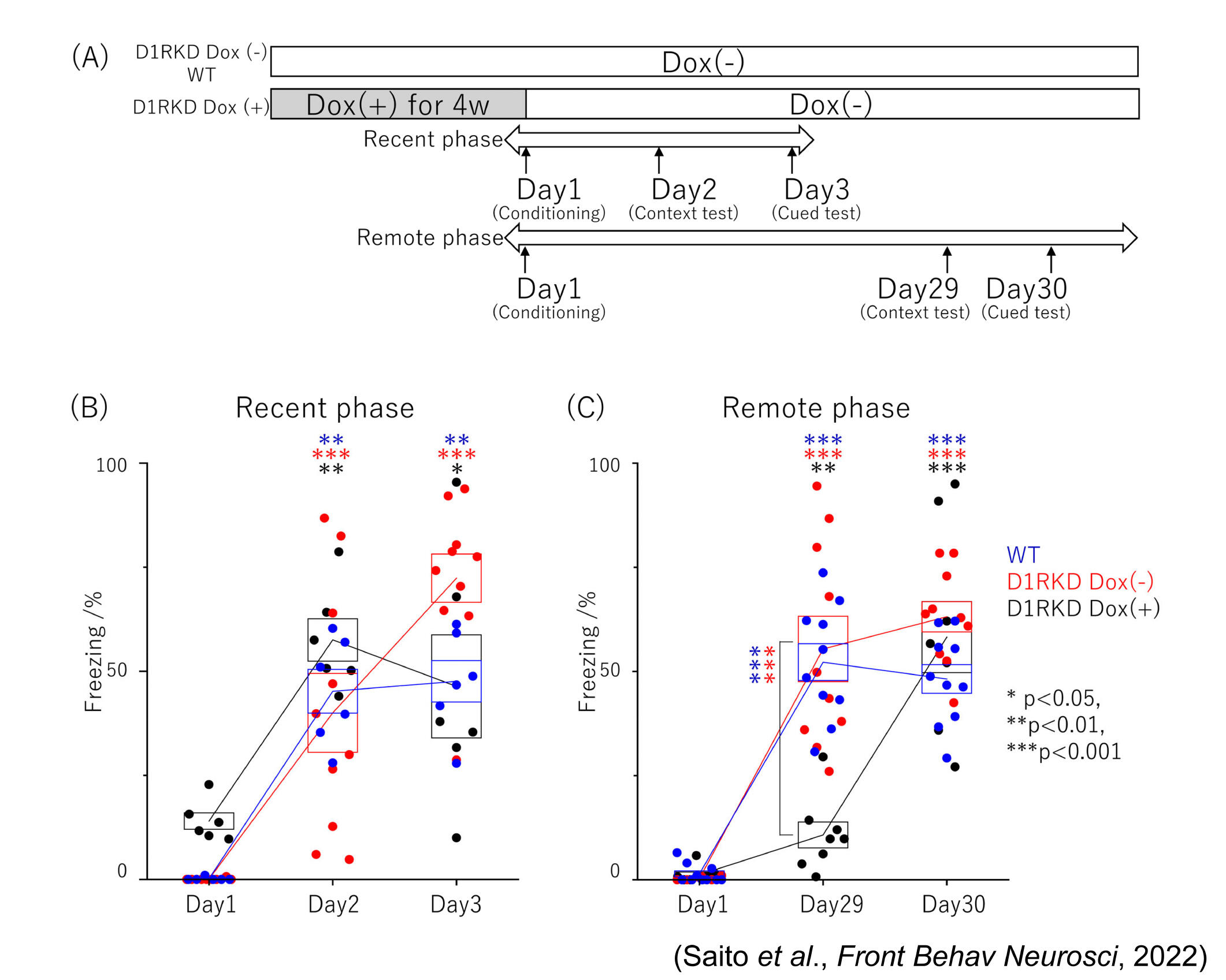
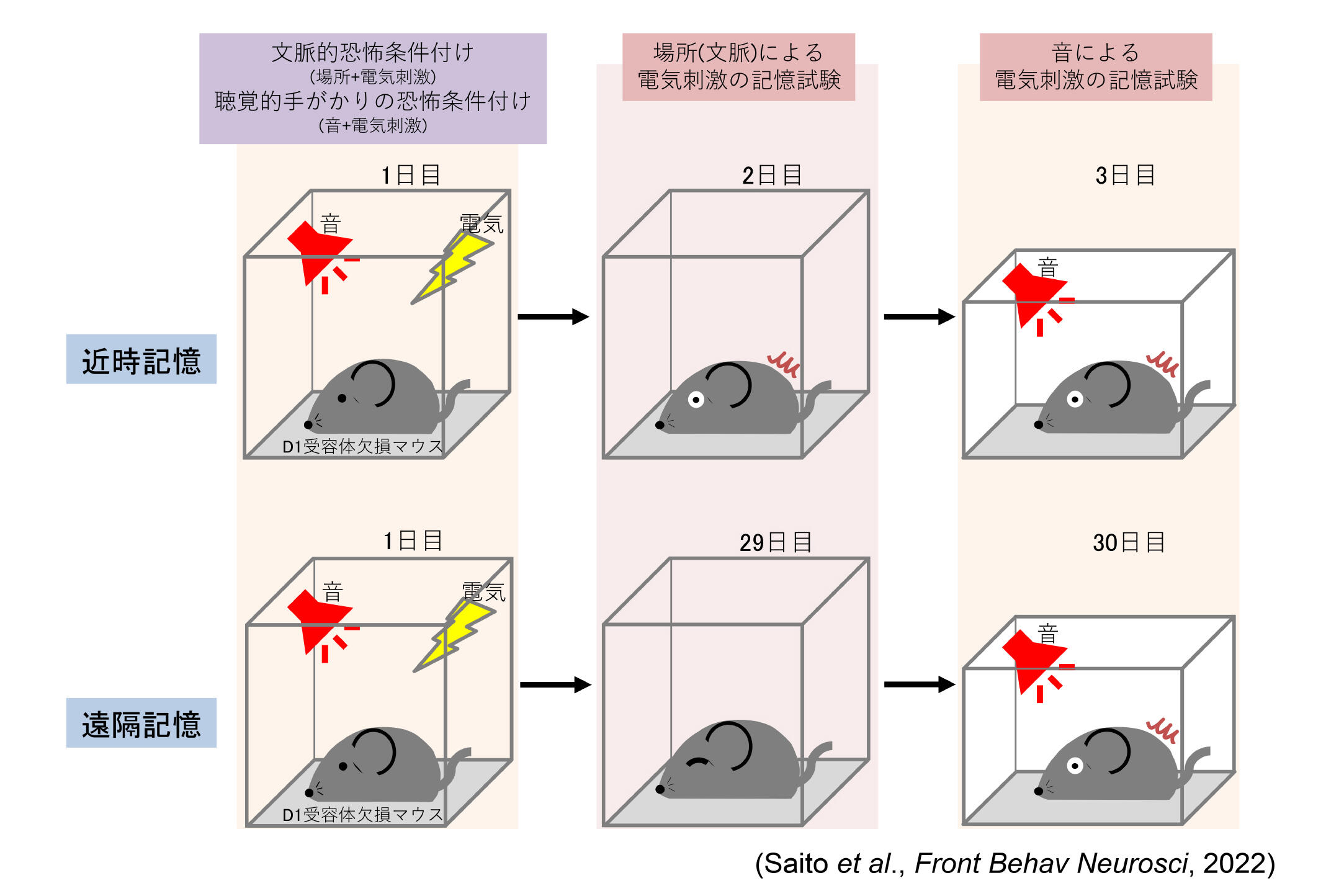
図3 文脈的恐怖条件付け試験および聴覚的手がかりの恐怖条件付け試験
(B)近時記憶の試験では、2日目の文脈的恐怖条件付けと3日目の聴覚的手がかり恐怖条件付けとして、3つのグループすべてのマウスのフリーズ時間を記録しました。
(C)遠隔記憶の試験では、29日目の文脈的恐怖条件付け試験と30日目の聴覚的手がかり恐怖条件付け試験にて、3つのグループのマウスのフリーズ時間を記録しました。
次に、D1RcKDマウスを用いて、2種類の恐怖条件付け試験、すなわち文脈的恐怖条件付けと聴覚的手がかりの恐怖条件付けを行い、記憶形成を近時記憶と遠隔記憶についての行動解析により評価し、活性化したニューロンをc-Fos発現解析により行いました[4]。c-Fosもまた最初期遺伝子の1つであり、c-Fosの発現上昇は、長期記憶形成に関連することが知られています[18-21]。聴覚的手がかりの恐怖条件付け試験において、D1Rの発現を抑制したD1RcKDマウスは、近時記憶形成にも遠隔記憶形成にも影響を受けませんでした(図3) [4]。c-Fosの発現様式の結果と併せて考えると、このことは本条件付けにおいて、D1R発現の低下によって扁桃体のc-Fos発現レベルが変化しなかったことが原因の一つの可能性として考えられます。また、ドーパミンシグナルが聴覚的手がかりの恐怖記憶形成に影響を及ぼすという報告もあり[22]、D1Rを介するシグナルではなくD2Rを介するシグナルが関与している可能性も考えられます。次に、文脈的恐怖記憶試験において、D1R発現を抑制したD1RcKDマウスは、近時記憶形成には影響がありませんでしたが、遠隔記憶形成の成績が低下し、同一のD1RcKDマウスがD1Rの発現が回復した段階では、遠隔記憶形成の成績が回復しました(図3、4、5)[4]。これは近時記憶でも成績が低下した受動的回避試験とは異なる結果でした。文脈的恐怖記憶試験は海馬依存の記憶形態と考えられていることから、嫌悪刺激による海馬及び線条体のc-Fos発現レベルの増加を免疫染色による組織化学法により観察すると、D1R発現を抑制したD1RcKDマウスの海馬CA1及びCA3領域において、嫌悪刺激によりc-Fos発現レベルの増加が見られました[4]。ただし、野生型マウスほどの発現量の増加ではありませんが、このCA1及びCA3におけるc-Fos発現レベルの増加が、文脈的恐怖条件付けの近時記憶形成に寄与した可能性があります[4]。あるいは、文脈的恐怖条件付けにおける近時記憶の形成は、海馬だけでなく線条体、扁桃体、前頭前野にも関係する報告があることから、扁桃体及び前頭前野のc-Fos発現レベルの増加も関与が考えられます[4]。一方、文脈的恐怖記憶の遠隔記憶形成の低下には、D1R発現を抑制した状態では、嫌悪刺激による海馬と線条体のc-Fos発現レベルの増加がみられないことが寄与していると考えられます[4]。
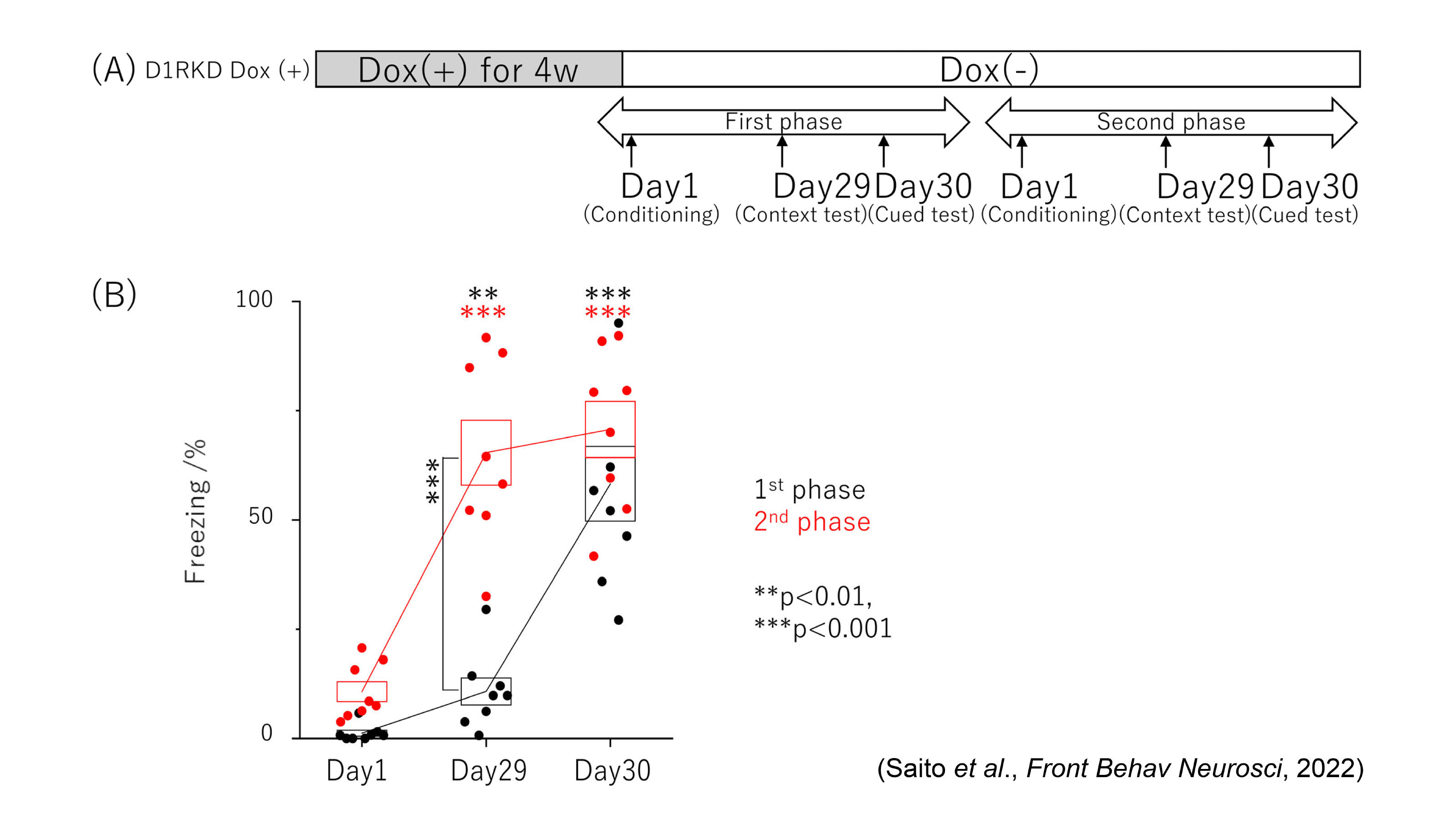
図4 遠隔記憶試験における文脈的および聴覚的手がかりによる恐怖条件付けテスト
(B)第1段階および第2段階において、同一マウスを用いて、それぞれ29日目の文脈試験および 30日目の聴覚的手がかり試験中にマウスのフリーズ時間を記録しました。黒い円は第1段階の値を示し、赤い円は第2段階の値を示します。
また、ストレスによるSNAP-25のSer187のリン酸化の誘発が知られていることから[23]、D1R発現を抑制したD1RcKDマウスにおいて解析すると、嫌悪刺激前でもすべての脳領域でSNAP-25のSer187のリン酸化レベルが増加していました[4]。D1R発現を抑制した状態で、嫌悪刺激前のSNAP-25のSer187のリン酸化増加は、記憶形成の低下に関与が考えられます。SNAP-25のSer187のリン酸化増加の認知機能への影響はこれまで報告がありませんが、記憶形成中のSNAP-25の発現量は厳密に調整され、正常な発現レベルからの過度な逸脱が認知機能に影響を与えると考えられます[24]。SNAP-25の活性変化は、注意欠如多動症(ADHD)や統合失調症等の認知障害に関連しており[25, 26]、今後、ドーパミンシグナルの記憶形成メカニズムの理解に、SNAP-25及びSer187のリン酸化の関与は重要な研究課題となるでしょう。
中脳辺縁系ドーパミンニューロンは、報酬学習における報酬予測誤差と呼ばれる学習信号を符号化する、すなわち報酬を予測する手がかり刺激提示直後に活動が増大し、もし、予想された報酬が得られなかった場合には報酬予測時刻に活動が低下するという、均一な役割を果たすと考えられてきました。一方、嫌悪刺激に対するドーパミンニューロンの反応については、長く論争されてきました。
しかし、最近の研究の進歩により、腹側被蓋野の腹内側部のドーパミンニューロンは、電気ショックなどの嫌悪刺激により活動することが観察され、腹側被蓋野の背外側部のドーパミンニューロンは、電気ショックで活動が低下することが観察されています。これらのように、ドーパミンニューロンが、腹側被蓋野の部位と投射先の違いにより、報酬に対する反応と嫌悪刺激に対する反応が異なる性質を示すなど、多様な行動に対して活動するという研究報告が増えており、ドーパミンニューロンの働きの理解が見直されてきています[27]。
ドーパミンニューロンが密接に関わる疾患は、パーキンソン病や統合失調症など多く知られていますが、いまだ根本的な治療や予防法がありません。病因は、遺伝負因や環境等の様々な因子が関与しており、また症状は発症時期にも依存し、個人差も大きい事が特徴です。そこで、ドーパミンニューロンの役割を解明することは、これらの疾患の治療や予防法の確立の一助となり、今後もさらなる研究が望まれます。
文献
- Chiken, S., et al., Dopamine D1 Receptor-Mediated Transmission Maintains Information Flow Through the Cortico-Striato-Entopeduncular Direct Pathway to Release Movements. Cereb Cortex, 2015. 25(12): p. 4885-97.
- Schultz, W., Recent advances in understanding the role of phasic dopamine activity. F1000Res, 2019. 8.
- Saito, N., et al., Neurotransmission through dopamine D1 receptors is required for aversive memory formation and Arc activation in the cerebral cortex. Neurosci Res, 2020. 156: p. 58-65.
- Saito, N., M. Itakura, and T. Sasaoka, D1 Receptor Mediated Dopaminergic Neurotransmission Facilitates Remote Memory of Contextual Fear Conditioning. Front Behav Neurosci, 2022. 16: p. 751053.
- Lorenzini, C.A., et al., Role of dorsal hippocampus in acquisition, consolidation and retrieval of rat's passive avoidance response: a tetrodotoxin functional inactivation study. Brain Res, 1996. 730(1-2): p. 32-9.
- Pittenger, C., et al., Impaired bidirectional synaptic plasticity and procedural memory formation in striatum-specific cAMP response element-binding protein-deficient mice. J Neurosci, 2006. 26(10): p. 2808-13.
- Ortiz, O., et al., Associative learning and CA3-CA1 synaptic plasticity are impaired in D1R null, Drd1a-/- mice and in hippocampal siRNA silenced Drd1a mice. J Neurosci, 2010. 30(37): p. 12288-300.
- Yao, R., et al., Maintenance of the Amygdala-Hippocampal Circuit Function with Safe and Feasible Shaking Exercise Therapy in SAMP-10 Mice. Dement Geriatr Cogn Dis Extra, 2021. 11(2): p. 114-121.
- Goshen, I., et al., Dynamics of retrieval strategies for remote memories. Cell, 2011. 147(3): p. 678-89.
- Ikegami, M., et al., Striatal dopamine D1 receptor is essential for contextual fear conditioning. Sci Rep, 2014. 4: p. 3976.
- Stubbendorff, C., et al., Dopamine D1-like receptors in the dorsomedial prefrontal cortex regulate contextual fear conditioning. Psychopharmacology (Berl), 2019. 236(6): p. 1771-1782.
- Mizuno, K., et al., Long-lasting transcription in hippocampal area CA1 after contextual fear conditioning. Neurobiol Learn Mem, 2020. 172: p. 107250.
- Phillips, R.G. and J.E. LeDoux, Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning. Behav Neurosci, 1992. 106(2): p. 274-85.
- Pare, D., G.J. Quirk, and J.E. Ledoux, New vistas on amygdala networks in conditioned fear. J Neurophysiol, 2004. 92(1): p. 1-9.
- Mastwal, S., V. Cao, and K.H. Wang, Genetic Feedback Regulation of Frontal Cortical Neuronal Ensembles Through Activity-Dependent Arc Expression and Dopaminergic Input. Front Neural Circuits, 2016. 10: p. 100.
- Okuno, H., K. Minatohara, and H. Bito, Inverse synaptic tagging: An inactive synapse-specific mechanism to capture activity-induced Arc/arg3.1 and to locally regulate spatial distribution of synaptic weights. Semin Cell Dev Biol, 2018. 77: p. 43-50.
- Vazdarjanova, A., et al., Spatial exploration induces ARC, a plasticity-related immediate-early gene, only in calcium/calmodulin-dependent protein kinase II-positive principal excitatory and inhibitory neurons of the rat forebrain. J Comp Neurol, 2006. 498(3): p. 317-29.
- Milanovic, S., et al., Production of the Fos protein after contextual fear conditioning of C57BL/6N mice. Brain Res, 1998. 784(1-2): p. 37-47.
- Tischmeyer, W. and R. Grimm, Activation of immediate early genes and memory formation. Cell Mol Life Sci, 1999. 55(4): p. 564-74.
- Fleischmann, A., et al., Impaired long-term memory and NR2A-type NMDA receptor-dependent synaptic plasticity in mice lacking c-Fos in the CNS. J Neurosci, 2003. 23(27): p. 9116-22.
- Miyashita, T., et al., Long-Term Memory Engram Cells Are Established by c-Fos/CREB Transcriptional Cycling. Cell Rep, 2018. 25(10): p. 2716-2728 e3.
- Jo, Y.S., G. Heymann, and L.S. Zweifel, Dopamine Neurons Reflect the Uncertainty in Fear Generalization. Neuron, 2018. 100(4): p. 916-925 e3.
- Yamamori, S., et al., Stress-induced phosphorylation of SNAP-25. Neurosci Lett, 2014. 561: p. 182-7.
- McKee, A.G., et al., AAV-mediated chronic over-expression of SNAP-25 in adult rat dorsal hippocampus impairs memory-associated synaptic plasticity. J Neurochem, 2010. 112(4): p. 991-1004.
- Mill, J., et al., Haplotype analysis of SNAP-25 suggests a role in the aetiology of ADHD. Mol Psychiatry, 2004. 9(8): p. 801-10.
- Gosso, M.F., et al., The SNAP-25 gene is associated with cognitive ability: evidence from a family-based study in two independent Dutch cohorts. Molecular Psychiatry, 2006. 11(9): p. 878-886.
- De Jong, J.W., K.M. Fraser, and S. Lammel, Mesoaccumbal Dopamine Heterogeneity: What Do Dopamine Firing and Release Have to Do with It? Annual Review of Neuroscience, 2022. 45: p. 109-129.





