2023年5月31日公開
担当:松井秀彰先生
所属:脳病態解析分野 松井研究室
その1ではこれまでのパーキンソン病の研究の歴史、特にマウスモデルや小型のモデル動物による研究の知見を簡単に振り返った。そこでの考え方、あるいは現在の基本的な研究の考え方は、今そこにあるパーキンソン病という病気から得られた知見をどのように研究に活かし、そしてパーキンソン病という病気の治療や予防に役立てるか、である。その2では視点を変えて、パーキンソン病の歴史は歴史でも進化の歴史というものがあるかどうか考えてみたい。
1.病気と進化 多くの研究者が莫大なリソースを投資しこれらの脳疾患の克服を目指して研究を進めてきた。しかしながら研究者あるいは医学者はどうしても今見えるものを中心に病態を考えてしまう。これは網羅的解析や人工知能をもってしても解決できない問題である。例えばアルツハイマー病ではアミロイドβの蓄積、パーキンソン病ではαシヌクレインの蓄積、そういった見ることでわかることにほぼ全てのリソースがさかれてきたし、今でもそうである。一方でアミロイドβあるいはその元となるアミロイド前駆タンパク質、そしてαシヌクレイン、それらの分子の本当の意味での生理機能は明らかではない。これはその生理機能を解明するにあたり何を、どこを、いつ見ればいいかがわからないというのが一因である。原因となる、あるいは病態の理解に重要なそれらの分子の機能もわからないまま、脳疾患の表面的な理解だけでそれを克服しようとする全世界の試みは、残念ながら挫折していると言わざるを得ない。ここまで科学が進歩しても脳疾患を克服する気配を色濃くは感じることができない現状において、脳疾患はその表面的な理解だけでは太刀打ちできないだろうということは多くの人が感じ始めているのではないだろうか。
脳疾患というと非常に複雑でそれゆえにヒト特有のものと考えられるかもしれない。しかし一方で、様々な生き物がヒトと同様の脳疾患に自然経過や老化の過程で罹患するとして何の不思議があるだろうか。実は脳疾患の原因分子あるいは関連分子のその多くは進化の過程で魚や昆虫、あるいはより単純な生命にも存在する。もちろんある脳障害はヒトに至るまでの特殊な進化の産物、例えばウイルスが惹起するゲノム構造変化によるものかもしれないし、またあるものは例えば高度な社会生活に起因した障害、かもしれない。ほぼ全ての生理機能あるいは解剖学的な構造が進化の過程で獲得され、そして保存されたり変化したりするのと同様に、たくさんの病気にも進化における出現や変遷が存在するに違いない。進化というものはその生命が遺伝子を残すことに関して、基本的には促進するようなものが選択される。ただし、その選択は長期間のスパンでの最善の解とは限らず、ある程度場当たり的なまあまあの解であることも多いだろう。そうすると進化が積み重なった結果、不都合な病気が生じるケースもあると考えられる。
脳研究所の脳病態解析分野 松井研究室では細胞やマウス、ヒトサンプルはもちろんのこと、様々な魚を用いてパーキンソン病を含めた脳疾患の研究を進めている。その中でアフリカメダカという寿命が短い魚が短い期間でヒトの老化と似たような症状を呈することに注目してきた。研究の結果、このアフリカメダカが老化の過程でパーキンソン病に非常に類似した病態を呈すること、その病態はαシヌクレインの存在に依存していることを明らかにした(Matsuiら Cell Rep. 2019)。このように自然経過でヒト疾患に類似した病理を呈するものは研究に非常に有用であり、アフリカメダカのパーキンソン病をより深く解析することで新たな知見が生まれている(Matsuiら Nat. Commun. 2021; Matsuiら Proc. Natl. Acad. Sci. USA 2023;120:e2214652120.)。一方で比較的近縁な種類である日本のメダカではこのような現象、つまり老化とともにパーキンソン病に類似した病理を呈するということは観察されない。ゼブラフィッシュは研究によく用いられる魚であるが、進化の過程で後述するようになぜかαシヌクレインを失ったかもしれないのだが、やはり老化とともにパーキンソン病に類似した病理を呈するということはない。哺乳類だとマウスが研究によく用いられるが、実験的なパーキンソン病をおこしやすいマウスの種類とおこしにくいマウスの種類があるのではないかという話もある。
少し気をつけてほしいのだが、ヒトは進化の先端に位置する非常に高等な生命であり、一方で魚や虫は進化的に遅れている下等な生命だというのは誤った考えである。進化は今現在でも持続するものであり、現存の生命は全て進化の先端に位置する。先端とは別に優れていると言う意味ではなく、文字通り時の流れの中のNowの意味に過ぎない。この進化の先端に位置する生命の中で、あるものはパーキンソン病に罹患し、あるものはパーキンソン病に罹患しない、例え相互に近い種であっても、である。これは非常に大きなヒントになる可能性があり、ヒトがなぜパーキンソン病に罹患するのか、あるいはある動物はなぜパーキンソン病に罹患しないのか、が理解できればそれは治療や予防への大きな一歩である。より根本的には、進化の歴史の上である地点でパーキンソン病が出現したと考えられるが、その起源にまで迫ることがこの病気の本質を理解することではないか、とさえ思える。
別の病気でも例えばアルツハイマー病では、様々な動物のアルツハイマー病に類似した認知症の存在は、時折ニュースや論文レベルでも散見される。当然、同じようにアルツハイマー病になりやすい生物となりにくい生物が存在すると考えられる。そして進化の歴史の上で、どこかでアルツハイマー病が出現したのだろう。この疾患出現のポイントはパーキンソン病やアルツハイマー病、あるいは統合失調症やうつ病、などそれぞれに違うはずで、遺伝子の変化、環境の変化、体や脳の大きさの変化、習慣の変化、そのほか様々な変化それぞれがどう結びついて各々の病気や障害につながるのだろうか。
パーキンソン病の原因分子、あるいは病態の重要な鍵を握ると考えられている、αシヌクレインは魚類から登場する分子である。アルツハイマー病の重要分子であるアミロイド前駆タンパク質も、いくつかバリエーションがあるのだが、進化の過程で魚や昆虫にも存在する。
αシヌクレインの生理的な役割はわかっていないが、神経細胞(ニューロン)と赤芽球に多く存在することがわかっている。哺乳類では赤芽球が脱核し赤血球になるという成熟過程が存在する。αシヌクレインはこの脱核の際に急激に発現量が低下することがわかっている(Arakiら Int J Hematol 2018)。ただ赤芽球脱核、あるいは赤血球の成熟過程に役立っているかどうかはわからない。この赤芽球脱核は魚類や両生類、爬虫類、鳥類では見られない。αシヌクレインは魚類や両生類、爬虫類、鳥類にも存在するので、その場合は赤芽球脱核現象に関わりようがない。考えられるケースは少なくとも3つあり、1つは進化の過程でαシヌクレインの配列に変化が起きるが、その配列の変化が赤芽球脱核現象に役立つ可能性。もう1つは配列の変化に関係なく、哺乳類が赤芽球脱核現象を何らかの方法で手に入れた時に、そこに偶然いたαシヌクレインを利用した可能性。3つ目は赤芽球脱核に伴いαシヌクレインが減少するだけで、そこには何の関係もないという可能性。もちろん以上の3つの可能性は極端な例で、実際はその間のグレーゾーンかもしれない。実は赤芽球脱核現象自体の生理的なあるいは進化的な意義はまだまだわかっていないことも多いらしく、わざわざなぜに核を失うのか、進化のそのポイントをもしタイムマシーンで見ることができれば、非常に興味深いことがわかるだろう。もちろんタイムマシーンは使えないが、進化学や生命科学はこのような現象の謎もいずれは解明できるかもしれない。
進化の過程でのαシヌクレインの配列の変化は生理現象だけではなく、病気、ここではパーキンソン病にも関わってくると思われる。あるアミノ酸変異はより凝集を促し、別のアミノ酸変異は凝集を抑制することがわかっている。凝集することが病気にとって悪いか良いかはここでは別問題である。αシヌクレインが起こす病態は凝集だけでなく、細胞から細胞へと広がっていく伝播現象やそもそもの細胞毒性、神経毒性などが考えられる。これらはすべて完全には同じメカニズムではないだろう。わずか1つのアミノ酸変異や変化であっても、それぞれの病態に大きな影響が起こり得ることも知られている(Zhangら Nat. Neurosci. 2023; Matsuiら Proc. Natl. Acad. Sci. USA 2023;120:e2214652120.)。分子の進化の話は単体では存在し得ず、個体や病気との相関関係があるはずで、今後パーキンソン病との関係を明らかにできることを期待している(図)。
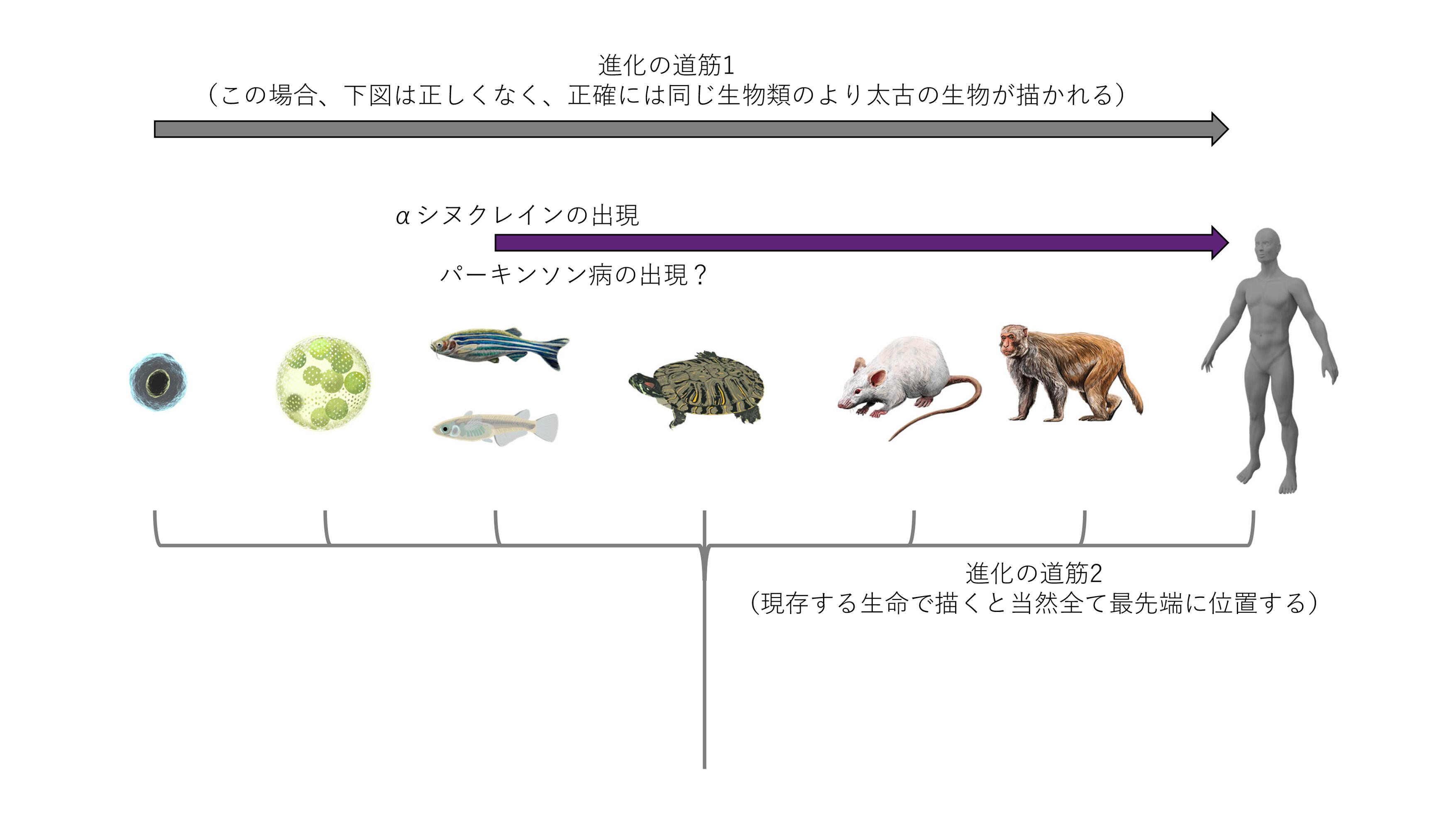
図:進化の模式図の中にαシヌクレインやパーキンソン病を仮記載した図
図や説明は今後の知見で変更がある可能性がある。生命体のイラストはTogoTVより使用。
ここで少し話題を変える。みなさんはウィリアムズ症候群という染色体疾患をご存知だろうか?ダウン症候群は知っている方が多いと思うが、同じように染色体の構造が定型発達の人とは違う。ウィリアムズ症候群の場合は7番染色体の部分欠失に起因し、そこに位置する複数の遺伝子が欠失する。そのことが原因で、発達障害、心血管病変などの様々な問題を抱えてしまう。大変に特徴的なのがそのとても人懐っこい性格で、ウィリアムズ症候群の方は私のような警戒心の強い大人相手でも、非常にフレンドリーに接してくれる。会話も流暢な方も多いので、すぐに打ち解けることができ、私はとても良い印象を持っている。まあそのことと各自が自立した生活を送ることができるかどうかは別問題で、近い未来の課題は山積みである。
ところで2017年のウィリアムズ症候群に関する進化遺伝学の研究成果は私には大きな衝撃だった。急に話が変わるように思うかもしれないが、イヌ、私は飼っていないが、多くの人に大人気のあのイヌ、犬が、オオカミから進化したことはご存じだろうか?より正確に表現すると、オオカミあるいはオオカミのような生物から進化は進み、あるものはオオカミ、別のものはイヌとなったのである。イヌは野生ではないらしく、ヒトが一緒に生活をしていく過程でいろいろな進化が存在する。オオカミはとっても怖いイメージがあるが、まあ野性の動物はみんなそんなもので、むこうはヒトが怖いので生活を脅かされるなら戦いになってしまうのは仕方がない。一方でイヌは概ねとても人懐っこく、長い時間を人間と共に、あるものは狩猟に、あるものはペットに、あるものは捜査に、あるものは介助に、と大活躍である。この2017年の論文では、研究グループはオオカミとイヌの遺伝子を比較しいくつかの違いを見出した。なんとその中の多くの遺伝子がウィリアムズ症候群で欠失のある遺伝子だったのである。研究グループはイヌ、ウィリアムズ症候群に共通する人懐っこさ、それがこの共通の遺伝子変化で説明できるのではないかと考えている(vonHoldtら Sci. Adv. 2017)。
オオカミとイヌといういずれも進化の真っ只中にいる現存の進化の先端の生命の、その重要性や貴重さを比較する人は少ないだろう。どちらも尊い生命で、ただその性質が違うだけである。しかしながらそれが人間の話になると、場合によっては異なった意見が出るのはなぜだろうか。例えばIQが高いのはある業務には適しているかもしれない。でもそれと個々の生命の重要性は全く関係ない。そもそも何が優れているか、なんていう考えは進化の長い歴史の中では愚問である。その時代時代で、その都度周囲の勢力の強い生命に存続を脅かされながら隅っこで細々と生きてきた生命の遠い子孫、それがヒトであることはよく知られているのだが。
多様性の重要性をよく耳にするようになった今、どれだけの人が多様性の意義を理解しているだろうか。このウィリアムズ症候群について、あるいは生命や人の多様性についてもっと言いたいことがたくさんあるのだが、ここではパーキンソン病ではないもので進化的な解析手法がいかに知見を与えてくれるかという例として挙げさせてもらうだけに留めておこう。
以上見てきたように進化学は分子の役割や生理-病理現象の進化的な意義を強力に伝えてくれる学問であり、生物の形態や機能についてこれまで多くの発見を産み続けている。最近ではスーパーコンピューターによる進化遺伝学的な解析なども進歩しており、より一層の新しい発見が期待されている。しかし脳というやや不可侵の印象もある臓器の病態研究は、表面的に見えるものだけにとどまっており、進化の視点から脳疾患を捉える研究はこれまでほとんど行われていない。
科学というものは"問い"の連続であり、何か大きな発見があっても、それに"なぜ"をつけることはほぼ無限に可能である。そういう意味ではとっても面白いけれども、反面キリがない。一方で医学は科学であると同時に社会要請にもさらされる。医学の場合ももちろん"問い"の連続ではあるが、解決と言っていい点が社会的には存在する。それはもちろんパーキンソン病など対象疾患の完全な克服である。だからかどうか限られた時間や予算やマンパワーの中では、物事を表面的に捉えてそれで解決できるかもしれないならそれで良い、という気持ちに流されそうになる。しかしそれはそれで一面の解だが、どこかで誰かが病の真の起源-そして真の病態を明らかにしようという試みは、少なくとも対象疾患を克服できていない現段階では続けなければならないと思う。それなしにはパーキンソン病あるいは他の何らかの疾患や難病は、もしかしたらずっと克服できないままかもしれないのだから。
参考文献
- Araki et al. The localization of α-synuclein in the process of differentiation of human erythroid cells. Int J Hematol. 2018;108:130-138.
- Matsui et al. Age- and α-Synuclein-Dependent Degeneration of Dopamine and Noradrenaline Neurons in the Annual Killifish Nothobranchius furzeri. Cell Rep. 2019;26:1727-1733.
- Matsui et al. Cytosolic dsDNA of mitochondrial origin induces cytotoxicity and neurodegeneration in cellular and zebrafish models of Parkinson's disease. Nat Commun. 2021;12:3101.
- Matsui et al. Phosphorylation of α-Synuclein at T64 Results in Distinct Oligomers and Exerts Toxicity in models of Parkinson's Disease. Proc. Natl. Acad. Sci. USA 2023;120:e2214652120.
- vonHoldt et al. Structural variants in genes associated with human Williams-Beuren syndrome underlie stereotypical hypersociability in domestic dogs. Sci Adv. 2017;3:e1700398.
- Zhang et al. Post-translational modifications of soluble α-synuclein regulate the amplification of pathological α-synuclein. Nat Neurosci. 2023;26:213-225.
研究分野

脳病態解析分野





