(2023年7月20日公開)
担当:井上貴博先生
所属:システム脳病態学分野 上野研究室
運動は健康に良いということは広く知られていることと思う。一般成人の健康増進には、中等度強度の有酸素運動を、1週間あたり150分以上おこなうことが各種ガイドラインで推奨されているが1、みなさんはいかがだろうか。
近年の研究から、運動は単に体に良いというだけでなく、認知機能の向上、加齢に伴う退行性変化や神経変性疾患の抑制、神経障害からの回復など、脳・神経系へも多様な効果をもつことが明らかになってきており、運動は脳の健康にも有益であるとわかってきている2。本コラムでは、脳の健康を支える機序の一つとして、運動による神経栄養因子の発現について紹介する。
1.運動による神経栄養因子の発現増強中枢神経系に広く存在している脳由来神経栄養因子(BDNF:Brain-derived neurotrophic factor)は神経栄養因子の1つであり、TrkB(Tropomyosin receptor kinase B)受容体と結合し細胞内シグナルを活性化することで、細胞の生存や成長、シナプスの可塑性などに有益な作用をもたらす3,4(脳研コラム:神経栄養因子の話(2017年7月)参照)。
運動が脳におけるBDNF発現を増強することは、1995年にNeeperらによって最初に報告された5。その後、運動によるBDNF発現増強は様々な脳領域(大脳皮質、海馬、線条体、小脳)や脊髄で起こることが、筆者らの研究を含め多数報告されている6-15。つまり、運動は多様な領域で神経栄養因子の発現を増強し、神経新生や回路機能の強化、神経保護作用など、神経機能の維持や可塑性の誘導にはたらくと考えられる(図1)。ちなみに、これらのげっ歯類を対象とした基礎研究では、運動効果の検証にトレッドミルや回し車による有酸素運動がしばしば用いられるのだが、ヒトにおいても自転車エルゴメーターなどの有酸素運動をした後に、血中BDNF濃度が増加することが示されている16(図1)。
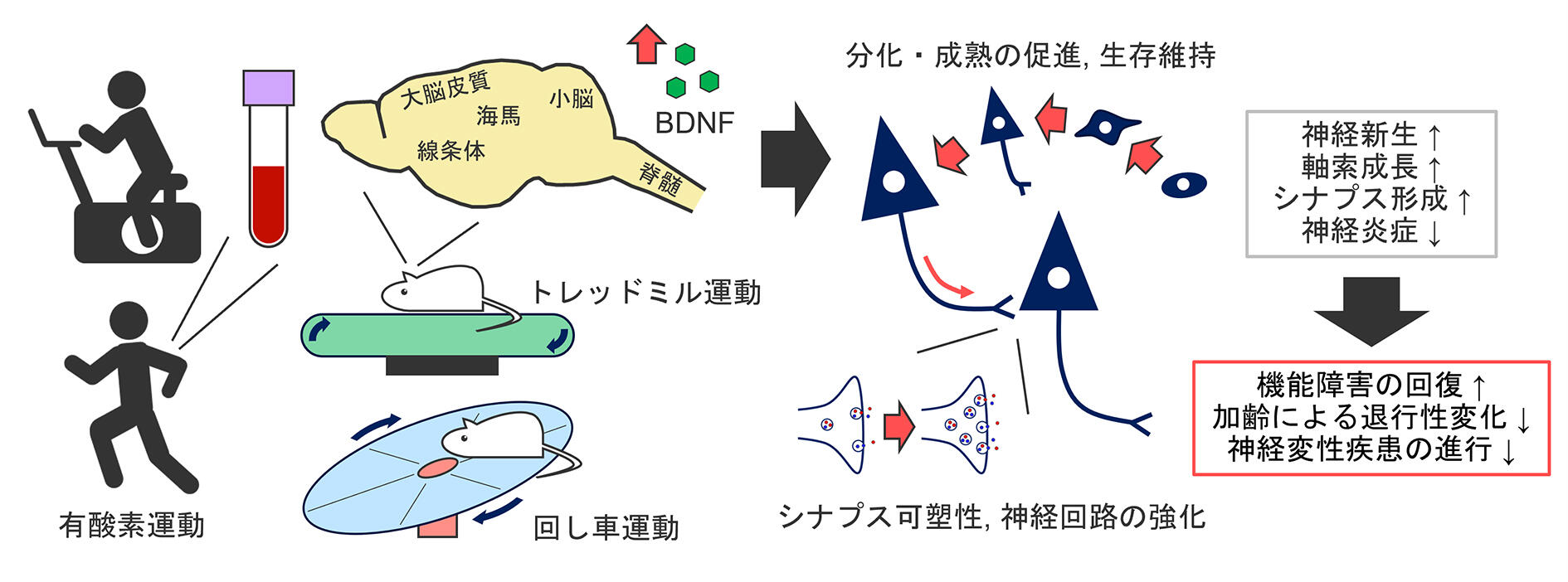
図1:運動によるBDNF発現増強と多様な可塑性
運動は様々な領域においてBDNFの発現を増強することがわかっており、ヒトにおいても運動後に血中BDNF濃度が増加することが示されている。運動により発現が増加したBDNFは、神経機能の維持や可塑性の誘導にはたらくことで脳の健康を支える。
一方、従来の研究におけるBDNFの発現解析は、ヒトの血液サンプルや実験動物から採取した脳サンプルを用いているため、実際に生きた脳内でBDNFの発現が増加しているのか不明のままであった。そこで、筆者らは、非侵襲的なイメージング技術によって、生きた個体で運動後のBDNF発現変化を捉えようと試みた。生体脳でのBDNF発現を可視化するため、ホタルの発光酵素であるルシフェラーゼを利用した遺伝子改変マウス(Bdnf-Lucマウス)を用いて、運動後の発現動態を観察した17。その結果、BDNF発現にともなう発光は、運動をした1~3時間後において顕著に増加することを見出した。確かに運動は脳内でBDNFの発現を増強し、さらにその効果は限られた時間枠で生じることが明らかになった(図2)。
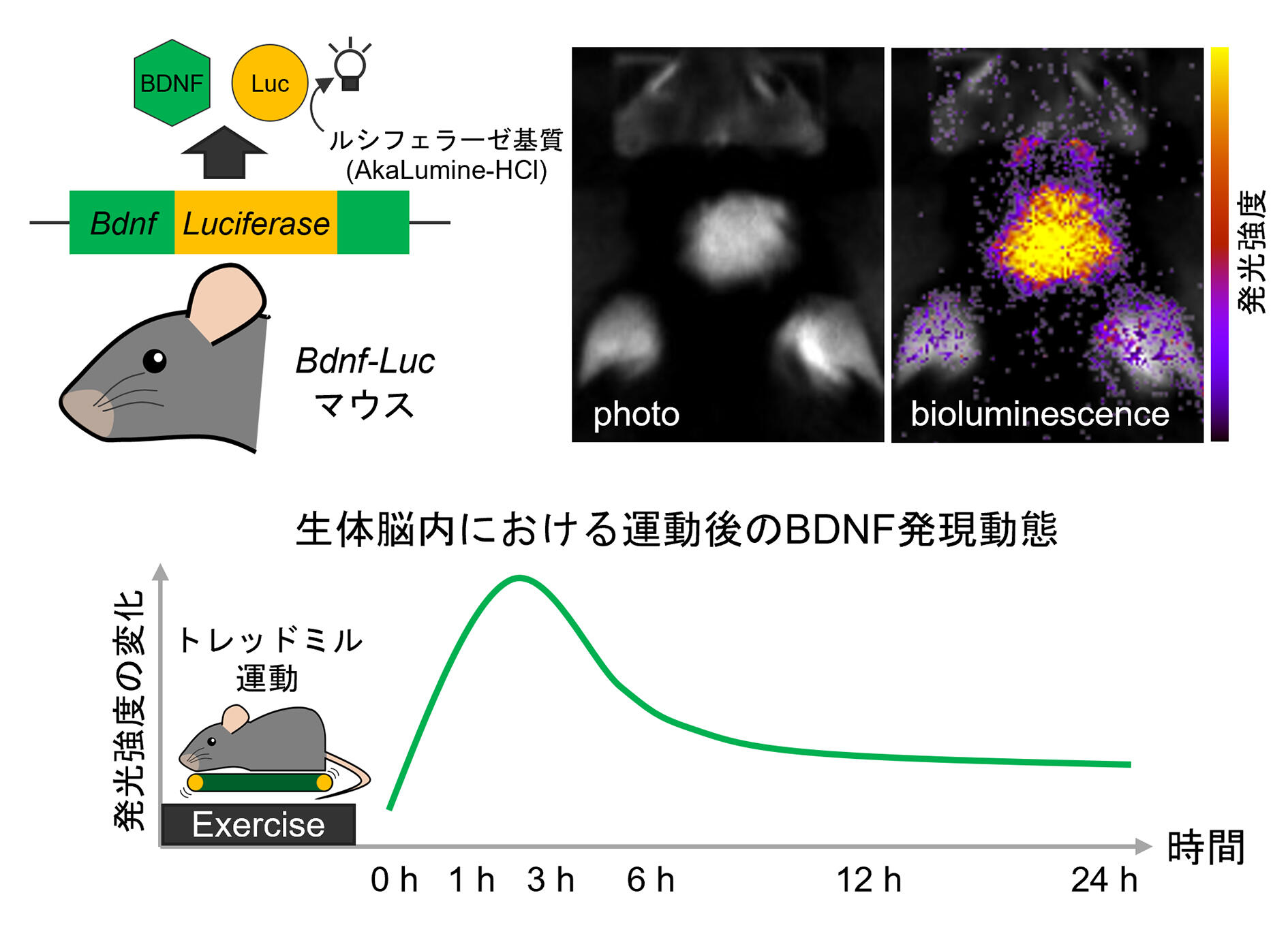
図2:生体脳イメージングを用いた運動後BDNF発現増強の検証
遺伝子改変マウス(Bdnf-Lucマウス)と非侵襲的なイメージング技術を用いて、生体脳内におけるBDNF発現変化を可視化したところ、運動後1〜3時間で顕著な発光増加が認められた17。
BDNFは神経活動に依存して発現が増加することが古くから知られている18。そのため、運動においては、身体運動に伴い生じる神経活動が、BDNFの発現増加をもたらす機序であると考えられる。実際、運動は神経活動を上げることが示されており19、筆者の研究においては、BDNF発現量が、自発活動量や神経活動マーカー(c-Fos)の発現量と相関することを見出している20。こうした脳内の機序に加えて、末梢組織から出てくる因子や代謝産物も脳のBDNF発現に作用することが近年わかってきた。中でも、筋で産生されたCathepsin b(CTSB)やIrisinなどのマイオカイン、肝臓由来のglycosylphosphatidylinositol-specific phospholipase D1(Gpld1)やケトン体(DBHB)は、血液を介して脳へ直接的(あるいは間接的)に作用し、BDNFの発現を増加することが示唆されている21-25(図3)。興味深いことに、運動したマウスの血漿を、運動をしていない別のマウスに投与すると、BDNFの発現や神経新生などの効果が運動をしていないマウスにもあらわれる24,26。したがって、運動がもたらす作用においては、脳だけでなく骨格筋や循環系も重要な役割を果たしていることが推察される。このように、運動は生体内の多様なシステムを介してBDNFの発現を増強することが、近年の研究により徐々に明らかとなっている。
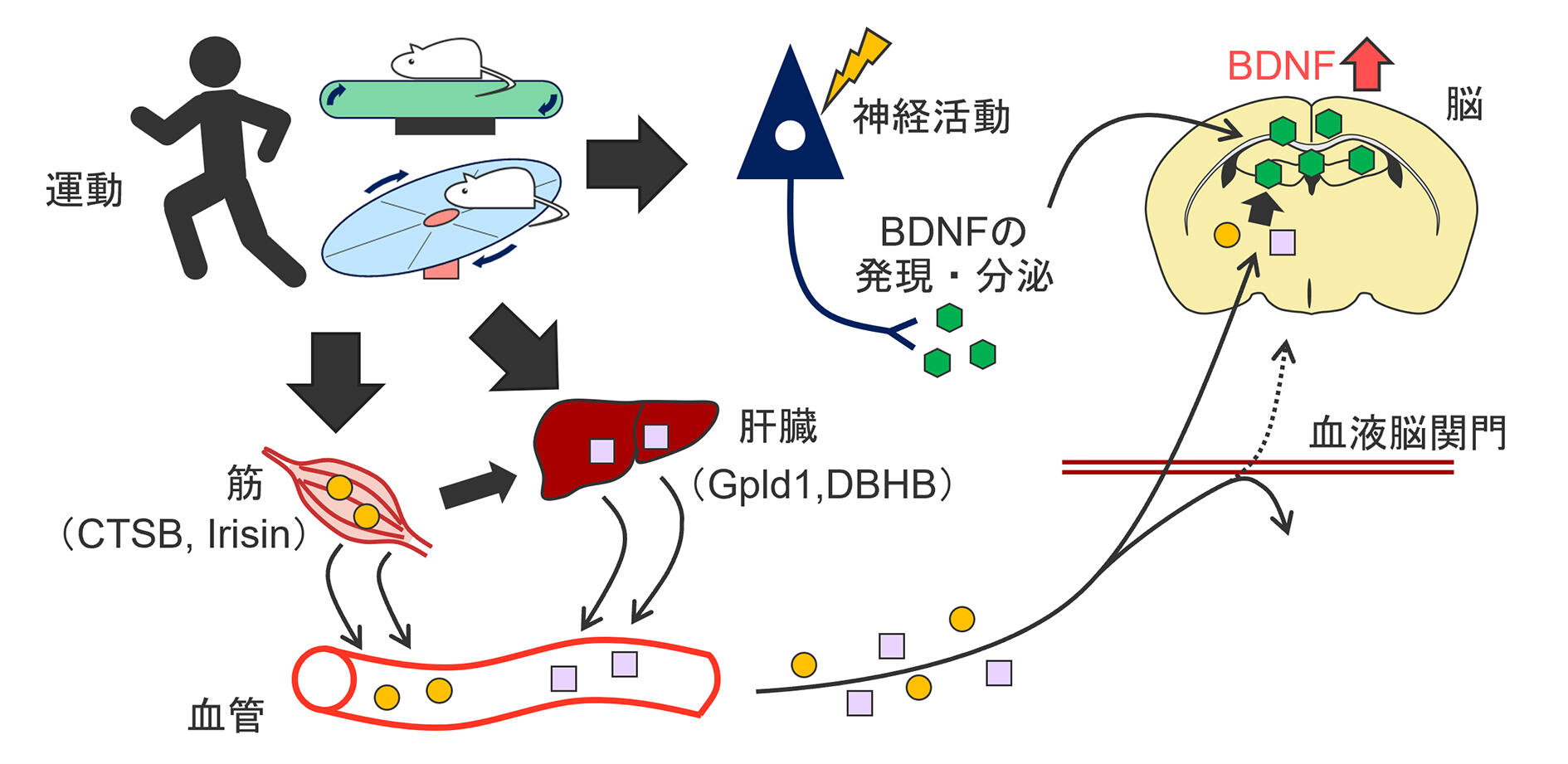
図3:運動によるBDNF発現増強の機序
運動は、神経活動だけでなく、体内の多様なシステムを介して脳のBDNF発現を増強していることがわかってきている。文献21-25をもとに作成。
加齢にともなう退行性変化の一つに、記憶・学習機能をになう海馬容積の減少や認知機能低下が挙げられ、これらは血中BDNF濃度の減少と関連していることが示されている27-29。また、アルツハイマー症やパーキンソン病、ハンチントン病などの認知症・神経変性疾患の死後脳サンプルにおいても、BDNF量が減少していることが明らかになっている30。これらに対して、運動はBDNF発現を増強するだけでなく、実際に海馬容積の増大や認知機能の改善をもたらし30、認知症や神経変性疾患の進行を遅らせる効果をもつことが示されている31,32。そのため、運動はアンチエイジングや脳疾患の予防・進行抑制をする非薬理的なアプローチとして期待される。
運動は、脳卒中や脳損傷などからの機能回復にも重要と示されている。脳がダメージを受けると、運動機能をはじめとする様々な機能障害が引き起こされる。機能の回復を図るには、リハビリテーション、特に、理学療法においては運動療法が中心的な治療介入となる。Ploughmanらは脳梗塞のモデルラットにおいて、走行運動と前肢のリーチング動作によりリハビリを行った。通常は機能が徐々に回復してくるが、実験的に脳のBDNF発現を抑制すると、機能回復が生じないことを実証した33。この知見は、リハビリをすることで誘導されるBDNFが、機能回復に重要な役割を果たしていることを示唆している。また、脳卒中においては、ダメージを逃れて残存した神経回路の可塑性(回路再編)が、機能回復を支えるメカニズムであることが近年明らかとなっている。例えば、随意運動をになう皮質脊髄路(脳研コラム:動きを生み出す脳の仕組みと謎(2020年3月)参照)では、BDNFとTrkB受容体による細胞内シグナルが、再編の誘導に働くことが示されている34。重要なことに、この回路再編は、運動介入によって促進され、機能を回復することがわかっている35,36。
4. 最適な運動とはここまで述べてきたように、運動はBDNFの発現を増強し、脳の健康を支えていることはわかってきた。しかし、どのような運動が脳に最適なのかは依然としてわかっていない。近年では、高負荷の運動を間欠的に行う高強度インターバルトレーニングがBDNFの発現増強に有効であるという報告が増えてきている一方で37,38、高負荷運動を高齢者や神経疾患の方に適用することは困難な場合が多い。また、強制的でストレスのかかりやすい運動は、BDNF発現を抑制するストレスホルモン(コルチコステロン)の産生を増やすため39、低負荷の運動でしかBDNF発現増強は望めないとする研究結果も存在する40,41。同じ運動であっても年齢や運動歴、病歴など個人の特性に応じてその効果は変動しやすく、一言で運動といっても、ウォーキングやジョギングなどの有酸素運動、いわゆる筋トレなどの抵抗運動(レジスタンストレーニング)など多様な運動様式があるため、運動の構成要素である「頻度 Frequency」「強度 Intensity」「時間 Time」「種類 Type」の"FITT"を目的に応じて選択していくことが大事である。今後さらに研究知見が集まりビッグデータ分析が進めば、自身の身体情報を入力して最適な運動プロトコルを教えてくれるAIが現れるかもしれない。
おわりに本コラムでは、運動がもたらす神経栄養因子発現と可塑性について紹介した。BDNF以外にも、インスリン様成長因子IGF-1(Insulin-like growth factor 1)や血管内皮細胞増殖因子VEGF(vascular endothelial growth factor)など、運動によって上がってくる因子が示されており42,43、近年の網羅的解析技術を用いた研究では、約10,000の因子が運動後に変動することが明らかになっている44。運動が脳の健康に有益であるという状況証拠は既に集まってきており、今後の研究では、運動に応答する各因子群がどのように作用し脳の健康を支えているのか、その機序を神経系や体内の多様なシステム、また病態との相互作用を考慮しながら、体系的に理解していくことが求められる。
以上に紹介したように、運動は脳の健康を保つ手段として一見短所がないように思うが、ある論文では、運動をする・継続するという動機(モチベーション)が必要であることが短所として挙げられている45。本コラムが、運動をしようと思う動機となり、みなさんの健康の一助となれば幸いである。
参考文献
- Warburton, D. E. R. & Bredin, S. S. D. Health benefits of physical activity. Curr Opin Cardiol 32, 541-556 (2017).
- Cabral, D. F. et al. Exercise for Brain Health: An Investigation into the Underlying Mechanisms Guided by Dose. Neurotherapeutics vol. 16 580-599 (2019).
- Park, H. & Poo, M. M. Neurotrophin regulation of neural circuit development and function. Nat Rev Neurosci 14, 7-23 (2013).
- Minichiello, L. TrkB signalling pathways in LTP and learning. Nat Rev Neurosci 10, 850-60 (2009).
- Neeper, S. a, Gomez-Pinilla, F., Choi, J. & Cotman, C. W. Exercise and brain neurotrophins. Nature 373, 109 (1995).
- Neeper, S. a, Gómez-Pinilla, F., Choi, J. & Cotman, C. W. Physical activity increases mRNA for brain-derived neurotrophic factor and nerve growth factor in rat brain. Brain Res 726, 49-56 (1996).
- Gómez-Pinilla, F., Ying, Z., Opazo, P., Roy, R. R. & Edgerton, V. R. Differential regulation by exercise of BDNF and NT-3 in rat spinal cord and skeletal muscle. European Journal of Neuroscience 13, 1078-1084 (2001).
- Gomez-Pinilla, F., Ying, Z., Roy, R. R., MOLTENI, R. & Edgerton Reggie, V. Voluntary Exercise Induces a BDNF-Mediated Mechanism That Promotes Neuroplasticity. J.Neurophysiol 88, 2187-2195 (2002).
- Gomez-Pinilla, F., Zhuang, Y., Feng, J., Ying, Z. & Fan, G. Exercise impacts brain-derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation. European Journal of Neuroscience 33, 383-390 (2011).
- Adlard, P. A., Perreau, V. M., Engesser-Cesar, C. & Cotman, C. W. The timecourse of induction of brain-derived neurotrophic factor mRNA and protein in the rat hippocampus following voluntary exercise. Neurosci Lett 363, 43-48 (2004).
- Venezia, A. C., Guth, L. M., Sapp, R. M., Spangenburg, E. E. & Roth, S. M. Sex-dependent and independent effects of long-term voluntary wheel running on Bdnf mRNA and protein expression. Physiol Behav 156, 8-15 (2016).
- Venezia, A. C., Quinlan, E. & Roth, S. M. A single bout of exercise increases hippocampal Bdnf: Influence of chronic exercise and noradrenalin. Genes Brain Behav. 1-12 (2017).
- Inoue, T. et al. Effects of long-term exercise and low-level inhibition of GABAergic synapses on motor control and the expression of BDNF in the motor related cortex. Neurol Res 40, 18-25 (2018).
- Maejima, H., Ninuma, S., Okuda, A., Inoue, T. & Hayashi, M. Exercise and low-level GABAA receptor inhibition modulate locomotor activity and the expression of BDNF accompanied by changes in epigenetic regulation in the hippocampus. Neurosci Lett 685, 18-23 (2018).
- Cefis, M. et al. The effect of exercise on memory and BDNF signaling is dependent on intensity. Brain Struct Funct 224, 1975-1985 (2019).
- Rasmussen, P. et al. Evidence for a release of brain-derived neurotrophic factor from the brain during exercise. Exp Physiol 94, 1062-1069 (2009).
- Inoue, T. et al. Temporal dynamics of brain BDNF expression following a single bout of exercise: A bioluminescence imaging study. Neurosci Lett 799, (2023).
- Zafra, F., Hengerer, B., Leibrock, J., Thoenen, H. & Lindholm, D. Activity dependent regulation of BDNF and NGF mRNAs in the rat hippocampus is mediated by non-NMDA glutamate receptors. EMBO J 9, 3545-3550 (1990).
- Chen, K. et al. Exercise training improves motor skill learning via selective activation of mTOR. Sci Adv 5, (2019).
- Inoue, T. et al. Specific inhibition of α5 subunit-containing GABAA receptors enhances locomotor activity and neuronal activity in the motor cortex. Biomedical Research 42, 103-108 (2021).
- Isaac, A. R., Lima-Filho, R. A. S. & Lourenco, M. V. How does the skeletal muscle communicate with the brain in health and disease? Neuropharmacology vol. 197 (2021).
- Stephan, J. S. & Sleiman, S. F. Exercise Factors Released by the Liver, Muscle, and Bones Have Promising Therapeutic Potential for Stroke. Frontiers in Neurology vol. 12 (2021).
- Pedersen, B. K. Physical activity and muscle-brain crosstalk. Nature Reviews Endocrinology vol. 15 383-392 (2019).
- Horowitz, A. M. et al. Blood factors transfer beneficial effects of exercise on neurogenesis and cognition to the aged brain. Science 369, 167-173 (2020).
- Sleiman, S. F. et al. Exercise promotes the expression of brain derived neurotrophic factor (BDNF) through the action of the ketone body β- hydroxybutyrate. Elife 5, 1-21 (2016).
- De Miguel, Z. et al. Exercise plasma boosts memory and dampens brain inflammation via clusterin. Nature 600, 494-499 (2021).
- Buchman, A. S. et al. Higher brain BDNF gene expression is associated with slower cognitive decline in older adults. Neurology 86, 735-741 (2016).
- Erickson, K. I. et al. Brain-derived neurotrophic factor is associated with age-related decline in hippocampal volume. Journal of Neuroscience 30, 5368-5375 (2010).
- Shimada, H. et al. A large, cross-sectional observational study of serum BDNF, cognitive function, and mild cognitive impairment in the elderly. Front Aging Neurosci 6, (2014).
- Zuccato, C. & Cattaneo, E. Brain-derived neurotrophic factor in neurodegenerative diseases. Nat Rev Neurol 5, 311-322 (2009).
- Valenzuela, P. L. et al. Exercise benefits on Alzheimer's disease: State-of-the-science. Ageing Research Reviews vol. 62 (2020).
- Sujkowski, A., Hong, L., Wessells, R. J. & Todi, S. V. The protective role of exercise against age-related neurodegeneration. Ageing Research Reviews vol. 74 (2022).
- Ploughman, M. et al. Brain-derived neurotrophic factor contributes to recovery of skilled reaching after focal ischemia in rats. Stroke 40, 1490-1495 (2009).
- Ueno, M., Hayano, Y., Nakagawa, H. & Yamashita, T. Intraspinal rewiring of the corticospinal tract requires target-derived brain-derived neurotrophic factor and compensates lost function after brain injury. Brain 135, 1253-1267 (2012).
- Nakagawa, H., Ueno, M., Itokazu, T. & Yamashita, T. Bilateral movement training promotes axonal remodeling of the corticospinal tract and recovery of motor function following traumatic brain injury in mice. Cell Death Dis 4, 1-9 (2013).
- Tanaka, T. et al. Combinational Approach of Genetic SHP-1 Suppression and Voluntary Exercise Promotes Corticospinal Tract Sprouting and Motor Recovery Following Brain Injury. Neurorehabil Neural Repair 34, 558-570 (2020).
- Jiménez-Maldonado, A., Rentería, I., García-Suárez, P. C., Moncada-Jiménez, J. & Freire-Royes, L. F. The impact of high-intensity interval training on brain derived neurotrophic factor in brain: A mini-review. Frontiers in Neuroscience vol. 12 (2018).
- Okamoto, M. et al. High-intensity Intermittent Training Enhances Spatial Memory and Hippocampal Neurogenesis Associated with BDNF Signaling in Rats. Cerebral Cortex 31, 4386-4397 (2021).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. X. & Tong, K. Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One 6, (2011).
- Lou, S. jie, Liu, J. yan, Chang, H. & Chen, P. jie. Hippocampal neurogenesis and gene expression depend on exercise intensity in juvenile rats. Brain Res 1210, 48-55 (2008).
- Wu, Y. et al. Intensity-dependent effects of consecutive treadmill exercise on spatial learning and memory through the p-CREB/BDNF/NMDAR signaling in hippocampus. Behavioural Brain Research 386, 112599 (2020).
- El-Sayes, J., Harasym, D., Turco, C. V., Locke, M. B. & Nelson, A. J. Exercise-Induced Neuroplasticity: A Mechanistic Model and Prospects for Promoting Plasticity. Neuroscientist 25, 65-85 (2019).
- Nicolini, C., Fahnestock, M., Gibala, M. J. & Nelson, A. J. Understanding the Neurophysiological and Molecular Mechanisms of Exercise-Induced Neuroplasticity in Cortical and Descending Motor Pathways: Where Do We Stand? Neuroscience 457, 259-282 (2021).
- Contrepois, K. et al. Molecular Choreography of Acute Exercise. Cell 181, 1112-1130.e16 (2020).
- Marosi, K. & Mattson, M. P. BDNF mediates adaptive brain and body responses to energetic challenges. Trends in Endocrinology and Metabolism vol. 25 89-98 (2014).





