希少疾患RVCLの発症機序が遺伝性乳がんと類似していることを発見 -DNA損傷と炎症の悪循環が疾患の発症に関与-
2024年06月10日
概要
新潟大学脳研究所分子神経疾患資源解析学分野の加藤泰介准教授、同脳神経内科学分野の安藤昭一朗助教、同脳病態解析分野の杉江淳准教授、同研究所所長の小野寺理教授らとペンシルバニア大学のJonathan Miner博士らの共同研究グループは、希少な遺伝性疾患である"脳白質脳症と全身症状を伴う網膜血管症(RVCL)"の原因である変異型のTREX1が、DNA二本鎖切断の修復機構の阻害を介してDNA損傷を蓄積させるメカニズムを解明しました。驚くべきことに、このメカニズムはBRCA1/2遺伝子変異を持つ乳がんの発症メカニズムと類似していることが明らかになりました。さらに、RVCL変異を持つ細胞は乳がんの治療でも使われるPARP阻害剤に対して高い感受性を示すこと、RVCL患者さんでは、若年性乳がんのリスクが高いことが明らかになりました。本研究は、TREX1が、RVCLと若年性乳がんのメカニズムに重要な役割を果たしていることを示すものです。
本研究成果のポイント
- RVCL変異型TREX1が相同組換え修復の阻害とDNA二本鎖切断の蓄積を引き起こすことを発見しました。
- RVCL関連TREX1遺伝子変異を持つ細胞がBRCA1/2関連乳がん治療薬であるPARP阻害剤に対して高い感受性を示すことを発見しました。
- RVCL患者さんでは、若年性乳がんのリスクが高いことを明らかにしました。
Ⅰ.研究の背景
RVCL (Retinal vasculopathy with cerebral leukoencephalopathy and systemic manifestations) は、脳、目、腎臓などの複数の臓器の小血管に障害を引き起こす希少な遺伝性疾患です。RVCLの原因遺伝子はエキソヌクレアーゼというDNA分解酵素(注1)の遺伝子TREX1です。しかし、この遺伝子の変異が臓器障害を引き起こす機序は明らかになっていませんでした。RVCL変異型TREX1は、本来、存在しないはずの細胞の核内にも存在することが知られていました。細胞の核にはDNAが存在します。また、RVCL患者さんの血管は、DNA損傷を引き起こす放射線照射による血管変性像と似た特徴を示すことが報告されていました。本研究グループは、これらの特徴に着目し、本疾患のメカニズムとしてDNA損傷の関与を疑いました。
Ⅱ.研究の概要・成果
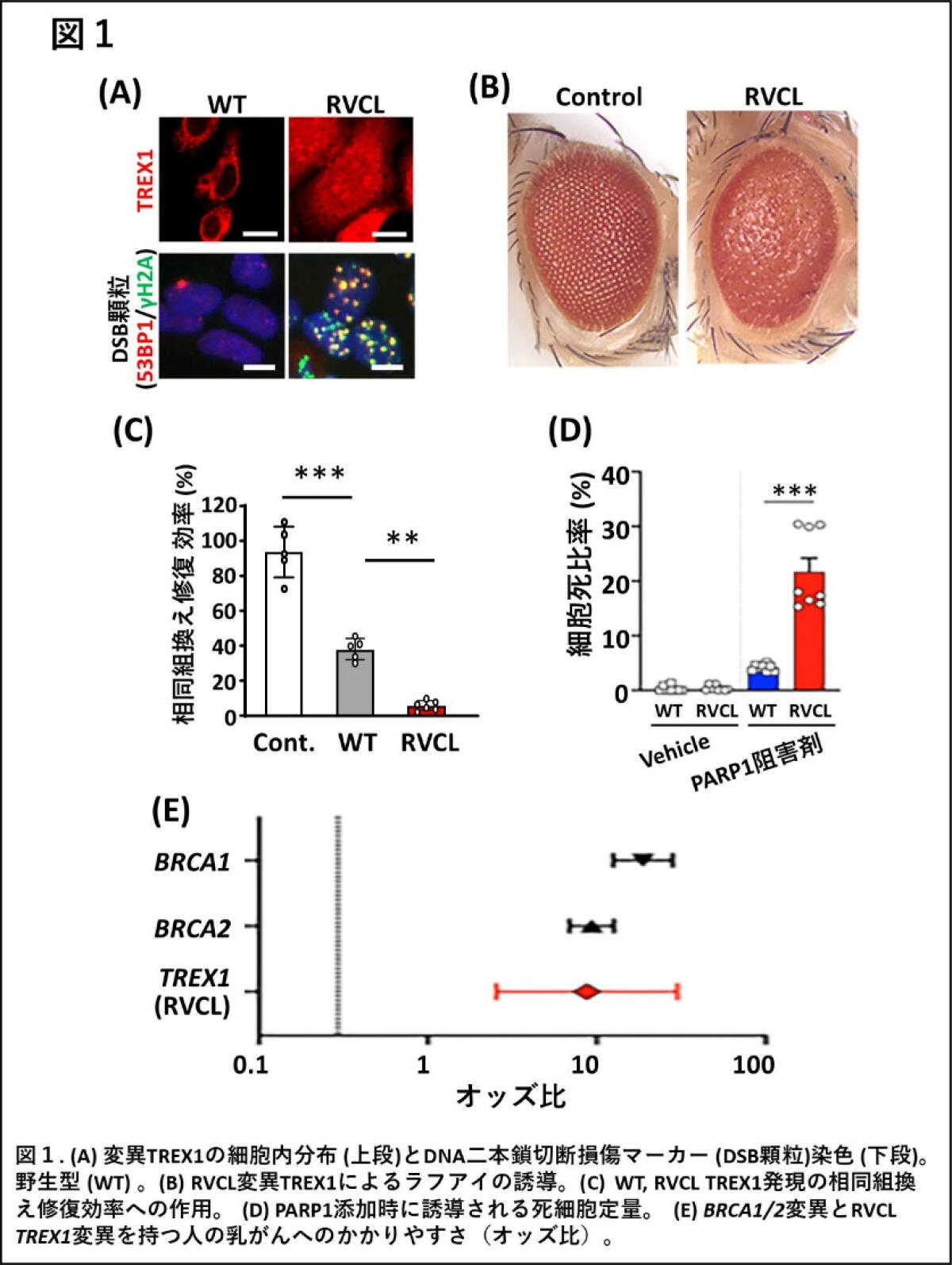
本研究では、RVCL変異型TREX1がDNA損傷を引き起こすメカニズムを、ショウジョウバエ、培養細胞を用いて解析しました。その結果、核内に異常に存在するRVCL変異型TREX1が、DNA切断の蓄積と細胞変性を引き起こすことを明らかにしました(図1A, B)。さらに、RVCL変異型TREX1が、DNA二本鎖切断損傷の修復機能の一つである相同組換え修復(注2)を阻害することを見出しました(図1C)。この相同組換え修復(注2)の阻害は、BRCA1/2遺伝子変異(注3)を持つ乳がんの発症メカニズムと驚くほど類似しています。
また、RVCL変異を挿入したマウス由来の細胞を用いた実験から、RVCL変異を有する細胞はPARP阻害剤(注4)に対する感受性が高くなっていることを見出しました(図1D)。PARP阻害剤は、相同組換え修復に欠陥のあるがん細胞に対して特に効果があることが知られている抗がん剤であり、BRCA1/2変異を持つ乳がん患者さんの治療に用いられています。RVCL変異型TREX1を発現する細胞がPARP阻害剤に高い感受性を示したことは、RVCL変異型TREX1と乳がん変異型BRCA1/2が類似の分子特性を持っている可能性を示唆しています。
そこで、ペンシルバニア大学で収集されたRVCL女性患者さん16人のデータと、アメリカ合衆国における大規模乳がん女性患者データ(97,900人)を用いた、乳がん発症率に関する比較調査を行いました。その結果、女性のRVCL患者さんでは、50歳未満で乳がんを発症する若年性乳がんのリスクが、一般集団と比べて約9倍高いことが示されました(図1E)。この結果は、RVCL変異型TREX1による相同組換え修復の阻害とDNA損傷の蓄積が、BRCA1/2変異を持つ乳がんと同様に、乳がんのリスク増加に関与している可能性を示唆しています。
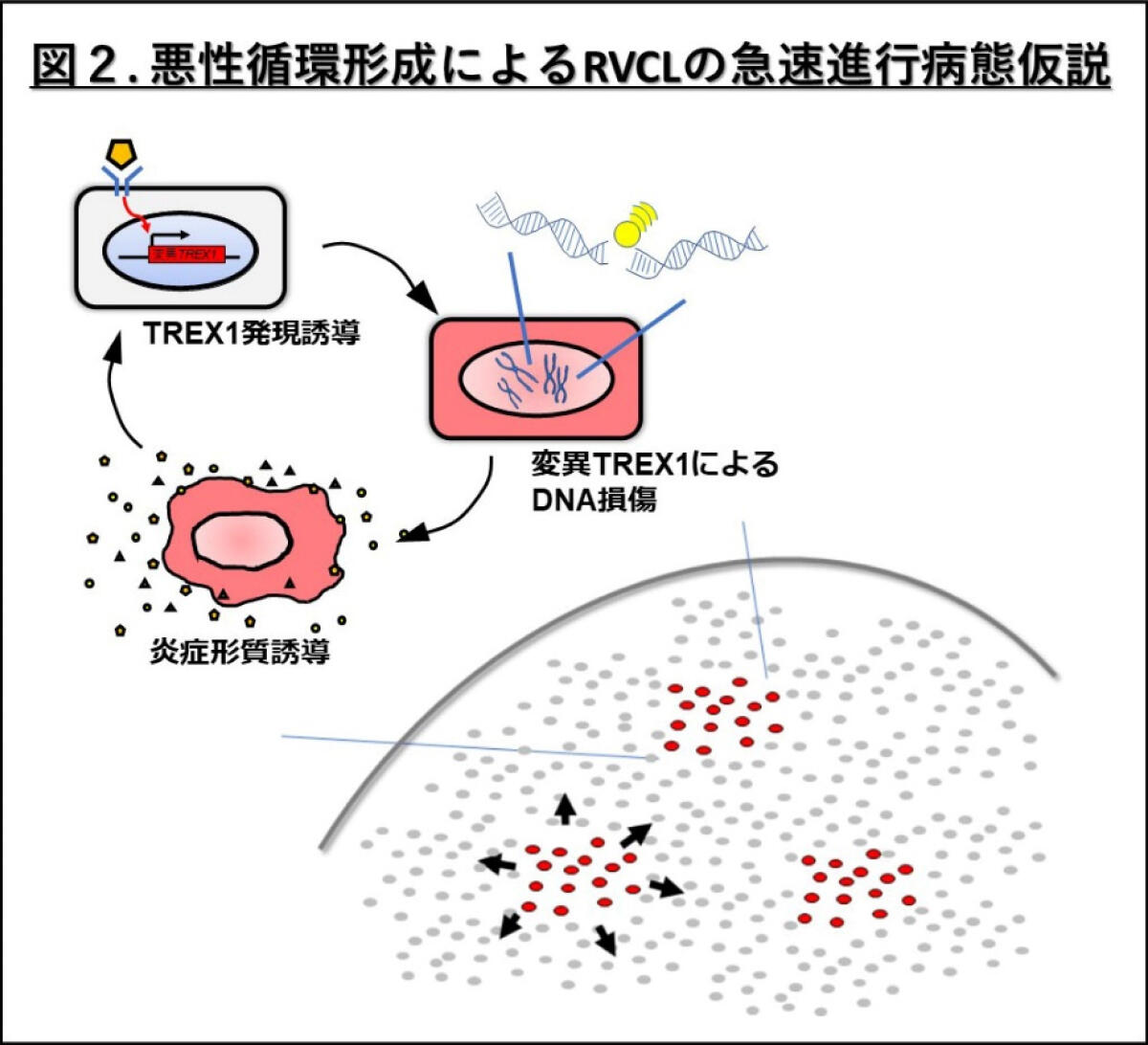
さらに本研究では、TREX1の発現量が高い細胞ほど、DNA損傷の程度が大きく、また、炎症性サイトカイン(注5)がTREX1の発現を増加させることも明らかになりました。これらの結果は、RVCL関連TREX1遺伝子変異を持つ細胞では、炎症が変異型TREX1の発現を増加させ、DNA損傷を引き起こす可能性を示唆しています。さらに、DNA損傷は炎症を惹起し、炎症性サイトカインの産生を増加させることも分かりました。これらの結果から、RVCL患者さんの組織内では、変異型TREX1によるDNA損傷と炎症が相互に影響し合い、悪循環を形成している可能性を示しています(図2)。
Ⅲ.今後の展開
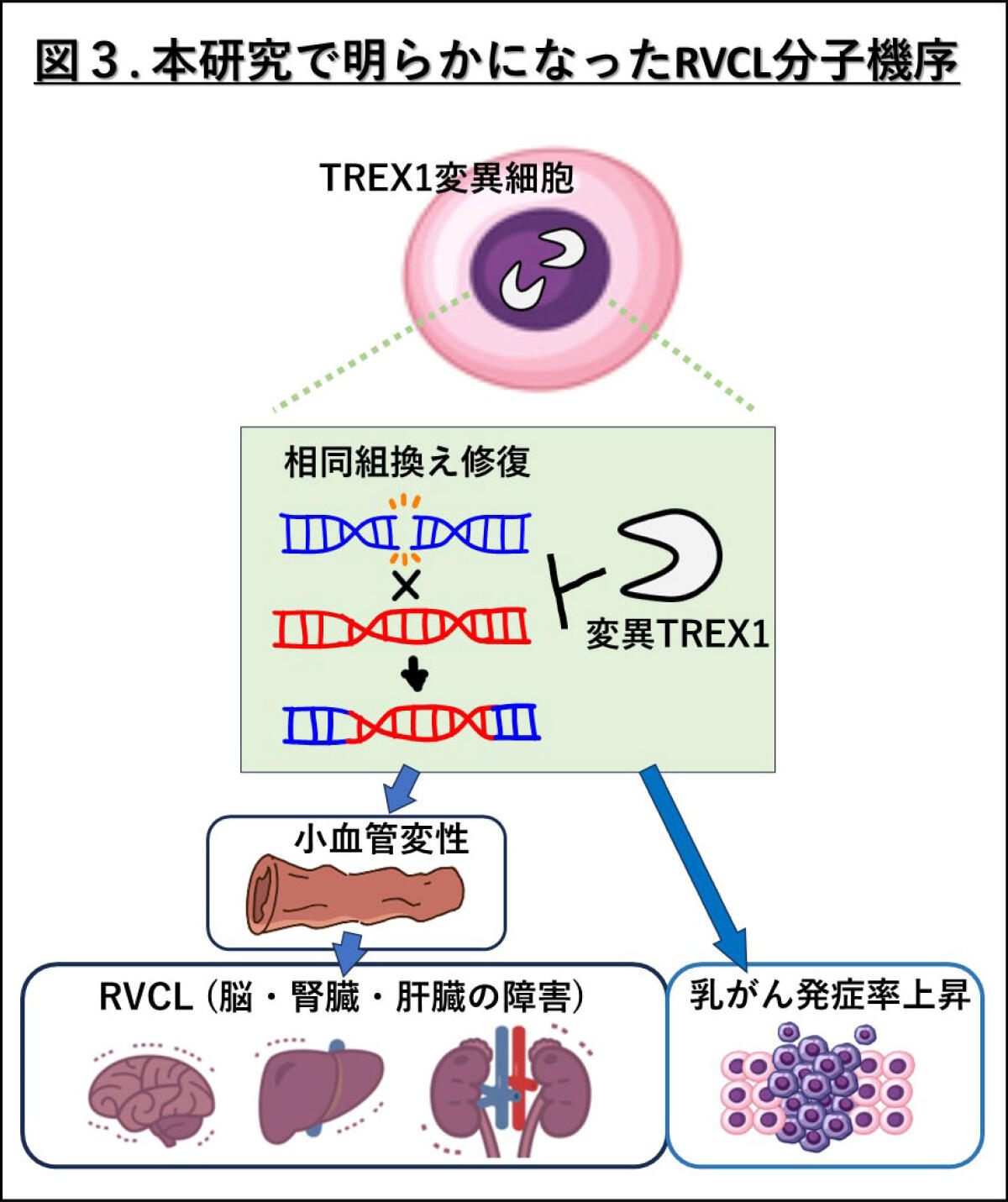
本研究により、TREX1の発現量と核への局在、そしてRVCL変異型TREX1による相同組換え修復の阻害とDNA損傷の蓄積がRVCLの病態メカニズムに重要な役割を果たしていること明らかになりました(図3)。また、DNA損傷と炎症が相互に影響し合い、悪循環を形成している可能性が示唆されました(図2)。
今後は、TREX1の発現量や局在を調節する因子の同定や、TREX1の核内での異常な蓄積を抑制する方法の開発が重要になると考えられます。また、DNA損傷と炎症の悪循環を断ち切る方法の開発も重要です。TREX1の機能を調節する化合物や、炎症を抑制する化合物の開発が、RVCLの予防や治療に役立つ可能性があります。さらに乳がんとの類似性から、PARP阻害剤耐性、乳がんの治療方法の開発や、放射線障害性中枢神経障害の解明につながる可能性があります。
本研究は、希少疾患であるRVCLの病態解明を目的としたものですが、その成果はTREX1の発現量と局在の異常、およびDNA損傷と炎症の悪循環が、BRCA1/2関連乳がんを含む様々な疾患の発症に重要な役割を果たしていることを示唆するものです。
Ⅴ.研究成果の公表
本研究成果は、2024年6月1日(米国時間)、科学誌「Nature Communications」に掲載されました。
| 論文タイトル | Inherited C-terminal TREX1 variants disrupt homology-directed repair to cause senescence and DNA damage phenotypes in Drosophila, mice, and humans. |
| 著者 | Samuel D. Chauvin,+, Shoichiro Ando,+, Joe A. Holley,+, Atsushi Sugie, Fang R. Zhao, Subhajit Poddar, Rei Kato, Cathrine A. Miner, Yohei Nitta, Siddharth R. Krishnamurthy, Rie Saito, Yue Ning, Yuya Hatano, Sho Kitahara, Shin Koide, W. Alexander Stinson, Jiayuan Fu, Nehalee Surve, Lindsay Kumble, Wei Qian, Oleksiy Polishchuk, Prabhakar S. Andhey, Cindy Chiang, Guanqun Liu, Ludovic Colombeau, Raphaël Rodriguez, Nicolas Manel, Akiyoshi Kakita, Maxim Artyomov, David C. Schultz, P. Toby Coates, Elisha D.O. Roberson, Yasmine Belkaid, Roger A. Greenberg, Sara Cherry, Michaela U. Gack, Tristan Hardy, Osamu Onodera, Taisuke Kato,*, Jonathan J. Miner*. +co-first author, *corresponding author. |
| doi | 10.1038/s41467-024-49066-7 |
▶ プレスリリース
Ⅵ.謝辞
本研究は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業 [JP22ek0109424]、日本学術振興会 科学研究費助成事業 基盤研究(A)[22H00466]、基盤研究(B)[22H02981]、基盤研究(C)[18K07522]、アメリカ国立衛生研究所 (NIH:National Institutes of Health)[K08AR070918, R01AI143982, R01NS131480, T32 GM007170]、the Rheumatology Research Foundation、the Colton Center for Autoimmunity、the Clayco Foundation、the Penn RVCL Sisters Fundの研究助成支援を受けて行われました。
用語解説
- (注1)エキソヌクレアーゼとは核酸(DNAまたはRNA)の末端からヌクレオチドを1つずつ切断する酵素です。TREX1は、DNAの3'末端から5'末端に向けて切断を行う3'-5'エキソヌクレアーゼです。
- (注2)相同組換え修復とは、切断された部分を正常な DNA を鋳型にしてコピーして、元に戻すDNA損傷修復機構の一つです。 この方法では、切断部分が完全に修復され、遺伝子情報が正確に保存されるのが特徴です。
- (注3)BRCA1/2はDNAの傷を完全修復する、相同組換え修復機構に関わるタンパク質です。このBRCA1/2タンパク質をコードするBRCA1/2遺伝子に変異が生じることによって、乳がんを発症するリスクが高くなります。
- (注4)PARP阻害薬は相同組換え修復とは異なるDNA修復機能を阻害する薬です。相同組換え修復機能が障害されている細胞は、この薬によって細胞死が起こるため、相同組み換え修復障害を原因とするがんの治療薬に用いられています。
- (注5)炎症性サイトカインとは、炎症反応を促進する働きを持つ、細胞から分泌される低分子のタンパク質の総称で、細胞同士の情報伝達を担っています。炎症性サイトカインは、細菌やウイルスなどの病原体が体内へ侵入した場合、炎症反応を起こして体を守る役割を持ちます。





