2026年2月13日公開
担当:佐藤 時春 先生
所属:システム脳病態学分野 上野研究室
はじめに
私たちの脳や脊髄は、無数の神経細胞が精緻につながることで、運動や感覚、思考といった高度な機能を生み出している。しかし、こうした機能を真に理解するためには、個々の神経細胞の性質だけでなく、神経細胞がどこからどこへ情報を伝えているのか、すなわち神経回路の構造を明らかにする必要がある。こうした目的のために発展してきたのが、トレーサーを用いた神経回路の標識法である。本コラムでは、古典的な標識法から、現在広く用いられているウイルスベクターを使った手法まで、神経回路の可視化を可能としてきた方法論の変遷について紹介する。
髄鞘や神経の変性を利用した古典的な回路標識法
神経回路研究の出発点は、神経細胞そのものを可視化することにあった。1873年に開発されたゴルジ法は、樹状突起や軸索を含む神経細胞全体の形を染め上げることを可能にし、運動ニューロンや錐体細胞など様々な種類の神経細胞の存在が明らかになった1。その後、神経細胞の細胞体や樹状突起の起始部に存在するニッスル小体を染色するニッスル法や、軸索を取り囲む髄鞘を染色するクリューバー・バレラ法など、神経細胞体や白質構造を可視化する手法が確立された2,3。
しかし、これらの方法では、「この神経細胞がどこへ投射しているのか」、「どの経路を通って情報が流れるのか」という回路レベルの問いには十分に答えられなかった。中枢神経系において、長距離の投射をになう軸索の多くは髄鞘(ミエリン)に覆われている。よって、髄鞘を可視化できれば、神経のつながりがわかるという発想が生まれた。1882年にCarl Weigertが開発したWeigert法は、元来、白質病変を観察する目的で考案された染色法であるが、その高い髄鞘の染色性ゆえに、髄鞘化した線維束を可視化する手法としても用いられるようになった4,5。本法の原理は、脂質を豊富に含む髄鞘を重クロム酸により髄鞘内に留めた後、ヘマトキシリンで染色し、可視化するという方法である。これにより、脳の主要な神経回路の構造が初めて描写されるようになり、回路の構造を理解する上で大きな貢献を果たした。しかし、Weigert法は、すべての髄鞘を染色するため、特定の神経回路を選択的に識別できないという限界があった。この限界を打破するために考案されたのが、神経路を損傷し、その後に起こる神経の変性を手がかりとして回路を推定するという方法論である。
最初の大きな前進をもたらしたのが、1886年にVittorio Marchiによって開発されたMarchi法である6。この方法は、軸索切断後に生じる変性した髄鞘をオスミウム酸で選択的に黒染することで、損傷神経路の走行を可視化する手法である。例えば、大脳皮質の運動野を損傷すると、そこから脊髄へ向かう神経線維が変性し、内包 → 脳幹 → 延髄錐体 → 脊髄へと連続して走行する様子が明瞭に観察された7。この発見によって、随意運動をになう皮質脊髄路が、大脳皮質にはじまり、脊髄へと投射する長距離の下行路であることが確立された(脳研コラム:「動きを生み出す脳の仕組みと謎」を参照)。また、サルを用いた実験で、視床から皮質へ投射する経路が明らかにされ8、初めて神経回路を実験的に検証できる段階に到達した。一方で、Marchi法は感度が低く、白質を走行する太い有髄線維は見えるが、その軸索がどこで終わり、どの細胞に情報を伝えているのかまでは分からなかったのである。
この壁を越えたのが、1951年にWalle Nautaによって開発されたNauta法である9。この方法は、損傷後に生じる変性した軸索とシナプス終末を鍍銀により高感度に染色できるため、髄鞘の有無に依存せず、神経回路の行き先まで追跡できるようになった。例えば、運動野を限局的に損傷したサルの研究では、皮質から下行する軸索が、脊髄前角や中間帯といった特定の灰白質領域に選択的に終末を形成することが示された10。また、赤核や脳幹からも脊髄へ投射する経路が明らかにされ11、大脳皮質、中脳、脳幹に由来する伝達路が、脊髄の異なる機能的区分に投射し、様々な運動を調節しているという研究の礎を築いた。さらにNauta法は、大脳皮質と視床の結びつきを理解するうえでも重要な役割を果たした。視床は、目や耳などからの感覚情報を大脳皮質に届ける中継核と考えられていた。しかし実際には、例えば、皮質の視覚野を損傷すると、対応する視床核(主に外側膝状体)に変性終末が現れることから12,13、視床の多くの核は皮質からの入力を受け取り、その情報を修飾して再び皮質へ送り返すことで、情報処理や制御の中心的役割を担っていると考えられるようになった。1950〜70年代にかけて、Nauta法は中枢神経系の回路解析における標準的手法として広く用いられた。
神経細胞の輸送機構を利用した標識法
1960年代頃より、神経回路研究は大きな転換点を迎える。神経細胞が分子を軸索に沿って輸送する性質を利用した標識法の登場である14。この性質を利用し、分子(トレーサー)に蛍光色素などを結合させることで、神経細胞の形態や投射経路を、神経路を損傷することなく、可視化できるようになった15。このトレーサーは、移動の方向に基づき、順行性、逆行性、経シナプス性の三種類に分類される(図1)。順行性トレーサーは細胞体から軸索終末へと標識が広がり、投射先を同定することができる。一方、逆行性トレーサーは軸索終末から細胞体へと取り込まれ、入力元となる神経細胞を明らかにする。経シナプス性トレーサーはシナプスを介して標識が伝播するため、神経細胞間の接続関係を解析する強力な手法である。これらの違いを利用して、入力・出力関係を明確にすることができるようになった。
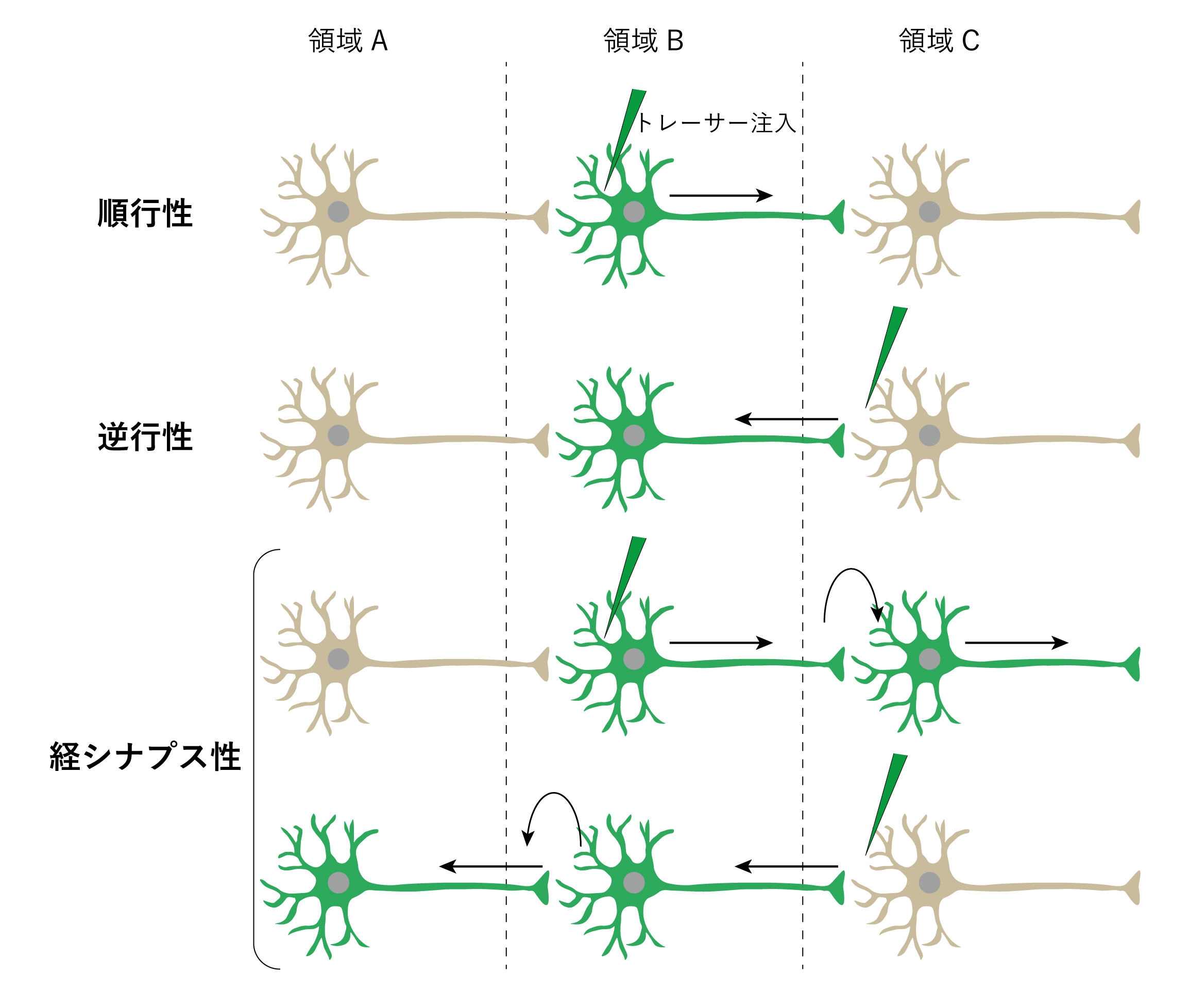
図1:神経トレーサーによる神経回路の標識法
順行性:トレーサーは細胞体から軸索末端へ輸送される。逆行性:トレーサーは軸索末端から取り込まれ、細胞体方向へ移動する。
経シナプス性:シナプスを超えて、トレーサーが伝播する。
当初は放射性標識したアミノ酸が順行性トレーサーとして使われたが16、より取り扱いやすい、ホースラディッシュペルオキシダーゼ(HRP)が次第に用いられ始め17、その後、コムギ胚芽凝集素(WGA)、コレラ毒素Bサブユニット(CTB)、脂溶性カルボシアニン色素(DiIなど)、蛍光ラテックスビーズ(retrobeadsなど)、ビオチン化デキストランアミン(BDA)などが広く用いられてきた18。
HRPは、エンドサイトーシスによって細胞内へ取り込まれエンドソーム/リソソーム系を含む小胞輸送機構を利用して、順行性および逆行性の両方向に輸送される15,19,20。特に細胞体への蓄積が検出しやすいことから、主に逆行性トレーサーとして用いられてきた15,19,20。一方で、HRPは取り込み効率や検出感度が比較的低く、さらに細胞毒性のため注入後の生存期間が制限される15,19,20。これらの問題を解決すべく登場したのが、WGAとHRPを結合させたWGA-HRPである。WGAは、コムギ胚芽由来のタンパク質で、糖鎖を特異的に認識して結合するレクチンであり、神経終末膜上の糖タンパク質や糖脂質に結合することで、エンドサイトーシスによって効率よく神経細胞内に取り込まれ、軸索輸送系に乗る15,19-21。また、弱い経シナプス標識が観察されることも報告され15,19-21、回路の階層構造を推定する手がかりとして利用されてきた。しかし、強い膜結合や注入部位の炎症などによる細胞への負担が次第に問題となってきた15,19-21。
1980年代になると、CTBや蛍光ラテックスビーズという逆行性トレーサーが導入され始めた。CTBは高感度でありながら毒性が低くかつ再現性が高いため急速に普及し、WGA-HRPに代わる標準的手法となっていった。コレラ毒素は本来、AサブユニットとBサブユニットから構成されるが、CTBは、この毒性が発揮する Aサブユニットを欠いている。そのため、神経終末膜上から効率よく細胞内に取り込まれ、軸索輸送に乗る一方で、細胞機能を大きく乱すことはない15,19,20,22。現在では、波長の異なる蛍光物質を結合したCTBが使用でき、様々な脳領域にこれらを注入することで、入力・出力の関係を解析することができる。例えば、一次視覚野の近傍に存在する複数の高次視覚領域に異なる蛍光標識のCTBを注入したのち、一次視覚野において逆行性標識された細胞を観察する。この際、蛍光の色が単色か多色に標識されているかを調べることにより、一次視覚野の神経細胞が単一あるいは複数領域に情報を送っているかが解析できる23。また、CTBを一次視覚野に注入するといった逆の解析も行われている24。これにより、一次視覚野と高次視覚領域の双方向のつながりが見え、この回路で情報がやり取りされることで、物体の認知や視覚の感度の調整などを行なっていることがわかってきた。
一方、神経細胞の出力先を可視化する目的で広く用いられているのが、BDAである。BDAはデキストラン骨格にビオチンを結合させた高分子トレーサーで、主に順行性トレーサーとして強い標識能を示す19,20,25,26。ビオチン-アビジン反応を利用した高感度な検出が可能で、細い軸索や終末ボタンまで描出できる点が大きな特徴である。BDAは分子量が大きく、細胞膜を自由拡散によって通過することはできない。そのため、注入部位においては、微小な膜損傷やエンドサイトーシスを介して神経細胞内に取り込まれると考えられている25,26。細胞体から軸索、さらには終末構造に至るまで連続的に標識できるため、「どの領域の神経細胞が、どこへ情報を送っているのか」を詳細に解析することができる。例えば、大脳皮質の感覚野および運動野にBDAを注入した研究により、皮質脊髄路の内部構造がより詳細に明らかになった。感覚野(一次体性感覚野)を起点とする皮質脊髄路は、主として脊髄の背側に軸索を投射するのに対し、運動野を起点とする皮質脊髄路は、腹側や中間灰白質の運動制御に関わる領域へ投射することが示された(研究成果参照)27。これらの知見は、Marchi法やNauta法といった古典的標識法によって存在が知られていた皮質脊髄路が、実際には起点となる皮質に応じて異なる投射様式と機能をもつ複数の回路から構成されていることを明らかにしたものである。このように、多くの中枢神経回路の構造の理解は、順行性、逆行性のトレーシング法によって大きく進展してきた。
ウイルス・遺伝子組換え技術が拓いた現代の回路解析
2000年代以降、神経回路研究は分子生物学、遺伝子工学との急速な融合を遂げ、従来の解剖学的手法を基盤としつつも、より精密で操作性の高い研究分野へと発展してきた。とりわけ、蛍光タンパク質を発現させるウイルスベクターを神経トレーサーとして用いる手法の登場は、神経回路解析の在り方を大きく変革した。現在では、アデノ随伴ウイルス(adeno-associated virus;AAV)、仮性狂犬病ウイルス(Pseudorabies virus;PRV)、狂犬病ウイルス(Rabies virus;RV)など、多様な特性をもつウイルスが目的に応じて使い分けられ、神経回路研究の中核的ツールとして広く利用されている(図2)28-31。
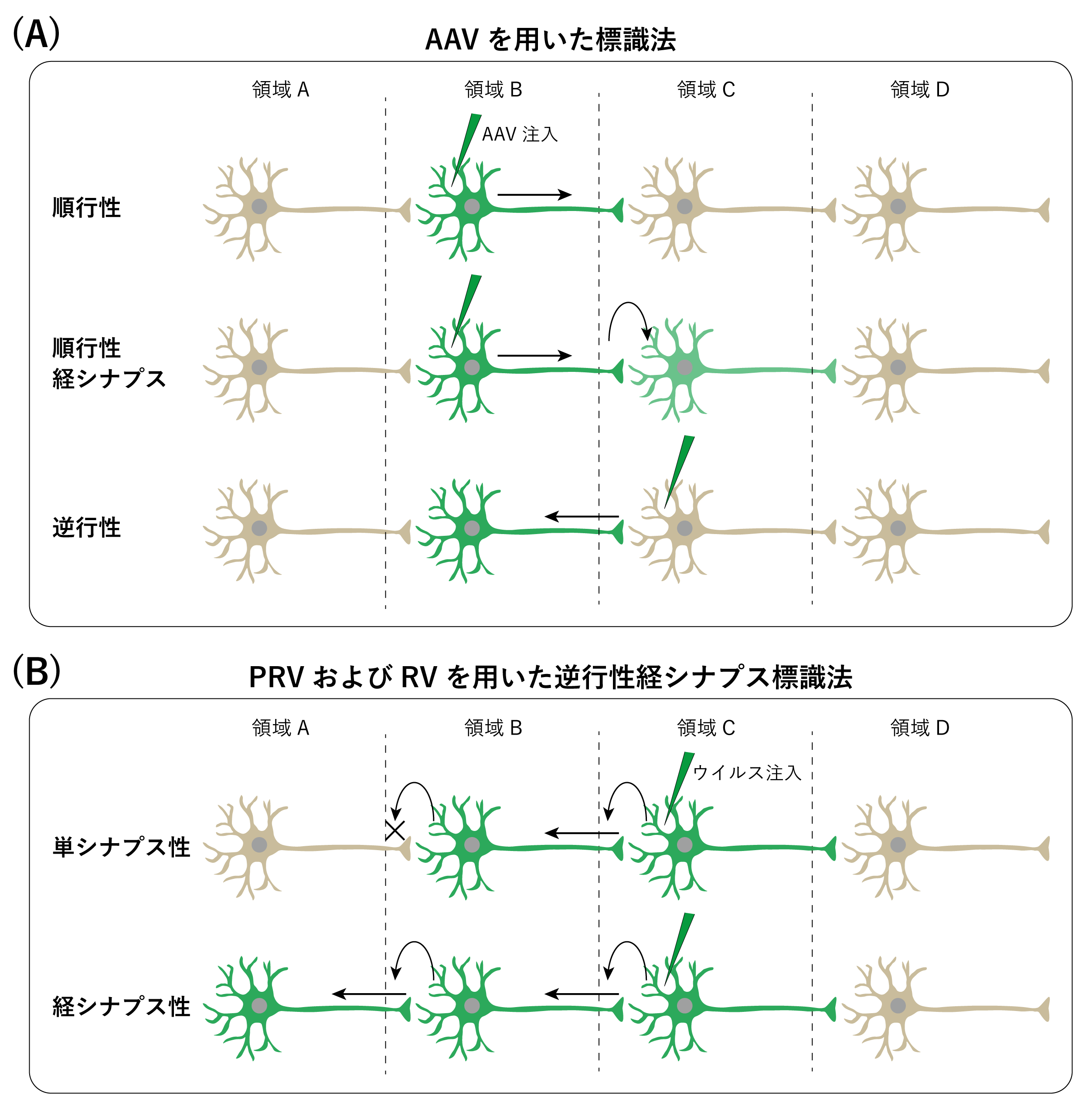
図2:ウイルスを用いた神経回路の標識法
(A) AAVを用いた順行性、順行性経シナプスおよび逆行性標識。(B) PRVおよびRVを用いた逆行性経シナプス標識。単シナプス性の場合、領域Cのニューロンに直接接続する領域Bのニューロンのみ標識される。
中でも、AAVは、神経細胞に対する毒性が低く、長期間にわたって安定した遺伝子発現を維持できるという利点を有する(図2A)32,33。多くのAAVは、基本的に順行性の挙動を示す。AAVを脳内の特定領域に注入すると、その部位の神経細胞体で感染が成立し、遺伝子発現が起こる。発現した蛍光タンパク質は、細胞体から軸索終末へと運ばれ、神経細胞の形態や投射経路が可視化される。この標識では、ウイルス粒子ではなく、発現したタンパク質が順行性に輸送されるが、AAVの中には、順行性経シナプス伝播の性質を併せ持つものも報告されている31,34。これらは限られた条件下で、ウイルス粒子が軸索終末まで輸送された後、放出され、シナプスを超えて下流の神経細胞に取り込まれる。これに対して、逆行性の性質を強めたAAVも存在する35。これは軸索終末から取り込まれ、逆行輸送されて細胞体に到達し、そこで遺伝子発現を起こすよう設計されている。このAAVを投射先の領域に注入することで、その領域に入力する神経細胞集団を同定することが可能となる。このように、特定の神経集団の形態や投射様式を観察するのに適したトレーサーとして重用されている。
また、自然界で神経指向性を持つウイルスを利用して、ヘルペスウイルスや弱毒株である狂犬病ウイルス、仮性狂犬病ウイルスが、経シナプストレーサーとして利用されてきた(図2B)36,37。例えば、筋肉に逆行性経シナプスに移動する狂犬病ウイルスや仮性狂犬病ウイルスを注入すると、脊髄の運動ニューロンから大脳皮質ニューロンへと伝播し、回路の起始部を同定することができる27,38。このように、シナプスを越えて情報が伝達される回路の連なりを可視化することが可能となり、入力・出力関係の解明が進められている。
さらに近年では、シングルセルの解析技術の発展などにより、同一脳領域内に存在する形態的・機能的に多様な神経細胞群が、遺伝子発現の異なる細胞種として分類できるようになっている。各細胞種に特徴的な発現遺伝子を指標にして、Cre/loxPシステムをはじめとする遺伝子工学的手法とウイルスベクターを組み合わせることで、細胞種あるいは回路特異的に神経細胞や軸索を標識することが可能となった。これにより、従来は一括して扱われてきた脳領域内の神経集団を細分化し、それぞれが担う機能的役割や回路上の位置づけを詳細に解析できるようになっている。例えば、大脳皮質に存在するグルタミン酸作動性ニューロンを発生起源や分子特性の違いによりサブタイプに分け、Cre依存性AAVや逆行性AAVを用いることで、異なるサブタイプが、それぞれ特異的な投射先や回路階層を形成していることが明らかにされている39。こうした手法により、同じ皮質層に位置する神経細胞であっても、情報の入力源や出力標的が大きく異なることが示され、皮質回路の機能的多様性が分子レベルで理解されつつある。
また、狂犬病ウイルスでは、特定の神経細胞種のみに感染し、一シナプスだけ逆行性に移動できるトレーシングシステムが開発されている28,40。例えば、一次体性感覚野に局在する抑制性ニューロンの3種類のサブタイプ(PV細胞、SST細胞、VIP細胞)を起点として、経シナプス性に逆行性トレーシングを行った結果、これらの抑制性ニューロンは、それぞれのサブタイプごとに異なる領域から情報の入力を受けることが明らかになった41。こうした技術の発展は、モデル動物における神経回路網の理解を飛躍的に深化させると同時に、行動や病態の神経基盤を回路レベルで解明する研究を強力に推進している。
おわりに
本コラムでは、神経回路の可視化技術について紹介した。神経回路標識技術は、新技術が旧来の方法を置き換えながら発展してきたが、その過程では変性、輸送、選択性とその方法論が徐々に磨き上げられてきた。神経回路を可視化するための試みは、今もなお進化を続けており、脳の働きを理解するうえで最も重要な基盤の一つであり続けている。
今後の神経回路研究では、脳内回路の複雑さ、すなわち階層的で多次元的な構造を理解するために、回路構造や細胞の種類、分子メカニズムをそれぞれ個別に調べるだけでは不十分であると考えられる。これらの情報を、脳内の位置や機能的文脈と結びつけて統合的に捉える枠組みが不可欠である。とくにマウスを用いた研究では、個々の実験データを共通の空間に配置し、異なる個体や条件、解析手法間で比較可能にすることが、神経回路の理解を深めるうえで重要である。その基盤として、Allen Brain Atlas に代表される高精度なマウス脳アトラスが広く利用されている。これらのアトラスは、脳領域の解剖学的境界、遺伝子発現、神経投射パターンなどの情報を統合した共通座標系を提供し、実験切片や神経細胞の位置情報を三次元空間上に再構築・マッピングする基準として機能している42。近年では、組織透明化技術やライトシート顕微鏡、シリアル切片イメージングの発展により、単一細胞レベルの情報を脳全体スケールで三次元的に再構成する試みが進んでいる43,44。これにより、従来は部分的にしか把握できなかった神経回路の全体像(コネクトーム)を、より包括的に解析できるようになりつつある。
一方、コネクトーム解析によって得られるデータは非常に膨大かつ高次元であり、従来の手作業による解析には限界がある。この課題に対して、Deep Learning を用いた画像解析やデータ統合手法が重要な役割を果たし始めている。例えば、畳み込みニューラルネットワーク(CNN)により、脳切片画像から脳領域を自動認識してアトラスに対応づけたり、神経細胞の検出・分類、さらには軸索や神経終末の自動抽出を行うことが可能となっている。これらの手法は解析の再現性を高めるとともに、研究の効率も大きく向上させている45-47。
このように、脳アトラスに基づく三次元マッピング技術と、Deep Learning による自動化・統合解析を組み合わせることで、分子、細胞、神経回路、さらには脳機能に至る多層的な情報を単一細胞の解像度で結びつけることが可能になりつつある。今後は、これらの技術を神経活動操作や行動解析と連携させることで、神経回路がどのような空間配置や分子基盤のもとで構築され、脳機能を形成しているのかについて、より因果的で体系的な理解が進むことが期待される。
参考文献
- DeFelipe J. Cajal and the discovery of the Golgi method: a neuroanatomist's dream. Anat Sci Int 100, 384-399 (2025).
- Ghosh SK, Walocha JA. Evolution of staining methods in neuroanatomy: Impetus for emanation of neuron doctrine during the turn of 20th century. Anat Rec (Hoboken) 307, 3398-3412 (2024).
- Garman RH. Histology of the central nervous system. Toxicol Pathol 39, 22-35 (2011).
- Weigert C. Ueber eine neue untersuchungsmethode des central-nervensystems. Centralbl Med Wiss. 42, 753-757 (1882).
- Kobayashi Y et al. Historical trends in neuroanatomical tract-tracing techniques. Anat Sci Int 100, 400-412 (2025).
- Marchi V, Algeri G. Sulle degenerazioni discendenti consecutive a lesioni sperimentali in deverse zone della corteccia cerebrale. Riv Sper Freniat Med Leg 12, 208-252 (1886).
- Hoche A. Beiträge zur anatomie der pyramidenbahn und der oberen schleife, nebst bemerkungen über die abnormen bündel in pons und medulla oblongata. Arch Psychiatr Nervenkr 30, 103-136 (1898).
- Walker AE. The primate thalamus. University of Chicago Press (1938).
- Nauta WJH, Gygax PA. Silver impregnation of degenerating axon terminals in the central nervous system: (1) technic. (2) chemical notes. Stain Technol 26, 5-11 (1951).
- Kuypers HG. Corticospinal connections: postnatal development in the rhesus monkey. Science 138, 678-80 (1962).
- Kuypers HG et al. Subcorticospinal projections in the rhesus monkey. J Comp Neurol 118, 107-37 (1962).
- Nauta WJ, Bucher VM. Efferent connections of the striate cortex in the albino rat. J Comp Neurol 100, 257-85 (1954).
- Guillery RW. Patterns of fiber degeneration in the dorsal lateral geniculate nucleus of the cat following lesions in the visual cortex. J Comp Neurol 130, 197-221 (1967).
- Dros B, Leblond CP. Migration of proteins along the axons of the sciatic nerve. Science 137, 1047-8 (1962).
- Lanciego JL, Wouterlood FG. A half century of experimental neuroanatomical tracing. J Chem Neuroanat 42, 157-183 (2011).
- Taylor AC, Weiss P. Demonstration of axonal flow by the movement of tritium-labeled protein in mature optic nerve fibers. Proc Natl Acad Sci U S A 54, 1521-7 (1965).
- Kristensson K, Olsson Y. Retrograde axonal transport of protein. Brain Res 29, 363-5 (1971).
- 村上富士夫. 神経回路追跡技術. 生産と技術 44, 18-21 (1992).
- van der Want JJ et al. Tract-tracing in the nervous system of vertebrates using horseradish peroxidase and its conjugates: tracers, chromogens and stabilization for light and electron microscopy. Brain Res Brain Res Protoc 1, 269-79 (1997).
- Saleeba C et al. A student's guide to neural circuit tracing. Front Neurosci 13, 897 (2019).
- Carcea M et al. Wheat germ agglutinin (WGA): its nature, biological role, significance in human nutrition, and possibility to be used as marker of whole-grain status in wheat-based foods. Foods 13, 2990 (2024).
- Stratmann T. Cholera toxin subunit B as adjuvant--an accelerator in protective immunity and a break in autoimmunity. Vaccines (Basel) 3, 579-96 (2015).
- Kim EJ et al. Extraction of distinct neuronal cell types from within a genetically continuous population. Neuron 107, 274-282 (2000).
- Morimoto MM et al. Organization of feedback projections to mouse primary visual cortex. iScience 24, 102450 (2021).
- Veenman CL et al. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. J Neurosci Methods 41, 239-54 (1992).
- Reiner A et al. Pathway tracing using biotinylated dextran amines. J Neurosci Methods 103, 23-37 (2000).
- Ueno M et al. Corticospinal circuits from the censory and motor cortices differentially regulate skilled movements through distinctspinal interneurons. Cell Rep 23, 1286-1300 (2018).
- Callaway EM, Luo L. Monosynaptic circuit tracing with glycoprotein-deleted rabies viruses. J Neurosci 35, 8979-85 (2015).
- Luo L et al. Genetic dissection of neural circuits: a decade of progress. Neuron 98, 256-281 (2018).
- Chadney O et al. Multiplexing viral approaches to the study of the neuronal circuits. J Neurosci Methods 357, 109142 (2021).
- Xu X et al. Viral vectors for neural circuit mapping and recent advances in trans-synaptic anterograde tracers. Neuron 107, 1029-1047 (2021).
- Husain T et al. Long-term AAV vector gene and protein expression in mouse brain from a small pan-cellular promoter is similar to neural cell promoters. Gene Ther 16, 927-32 (2009).
- Ertl HCJ. Immunogenicity and toxicity of AAV gene therapy. Front Immunol 13, 975803 (2022).
- Zingg B et al. AAV-mediated anterograde transsynaptic tagging: mapping corticocollicular input-defined neural pathways for defense behaviors. Neuron 93, 33-47 (2017).
- Tervo DG et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron 92, 372-382 (2016).
- Lanciego JL, Wouterlood FG. Neuroanatomical tract-tracing techniques that did go viral. Brain Struct Funct 225, 1193-1224 (2020).
- Ugolini G. Viruses in connectomics: Viral transneuronal tracers and genetically modified recombinants as neuroscience research tools. J Neurosci Methods 346, 108917 (2020).
- Rathelot JA, Strick PL. Subdivisions of primary motor cortex based on cortico-motoneuronal cells. Proc Natl Acad Sci U S A 106, 918-23 (2009).
- Matho KS et al. Genetic dissection of the glutamatergic neuron system in cerebral cortex. Nature 598, 182-187 (2021).
- Wickersham IR et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron 53, 639-47 (2007).
- Wall NR et al. Brain-wide maps of synaptic input to cortical interneurons. J Neurosci 36, 4000-9 (2016).
- Wang Q et al. The allen mouse brain common coordinate framework: a 3D reference atlas. Cell. 181, 936-953 (2020).
- Ueda HR et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron 106, 369-387 (2020).
- Liwang JK et al. Protocol for using serial two-photon tomography to map cell types and cerebrovasculature at single-cell resolution in the whole adult mouse brain. STAR Protoc 4, 102048 (2023).
- Stringer C et al. Cellpose: a generalist algorithm for cellular segmentation. Nat Methods 18, 100-106 (2021).
- Carey H et al. DeepSlice: rapid fully automatic registration of mouse brain imaging to a volumetric atlas. Nat Commun 14, 5884 (2023).
- Li Z et al. D-LMBmap: a fully automated deep-learning pipeline for whole-brain profiling of neural circuitry. Nat Methods 20, 1593-1604 (2023).





