(2022年7月1日公開)
担当:杉江 淳 先生
所属:脳病態解析分野 杉江研究室
はじめに
タンパク質は数珠状に繋がった高分子鎖であり、折り畳まれて、固有の立体構造を形成する (フォールディング) 。一方で、ミスフォールディングしたタンパク質は、凝集することがある。特定のタンパク質がミスフォールディングすると、凝集し核 (シード) を形成する。そして、モノマーがシードに結合することによって伸長して、アミロイド線維を形成する (図) [1]。アミロイド線維は、幅が約 10 〜 15 ナノメートルで長さが数マイクロメートルの糸の様な形態であり、その基本構造を見ると、線維軸と直行する方向に β ストランドが規則的に配列したクロス β 構造である (図) [2]。このような形状を持ったアミロイド線維の役割について、疾患に関わる負の部分が多く報告されている。一方で、幅広い種でアミロイド線維を形成する可能性を持つタンパク質 (本コラムでは「アミロイドタンパク質」と記す) が保存されており、生理的な意義も持つ。まだその数は少ないものの、機能的なアミロイド線維の例を本コラムで紹介する。
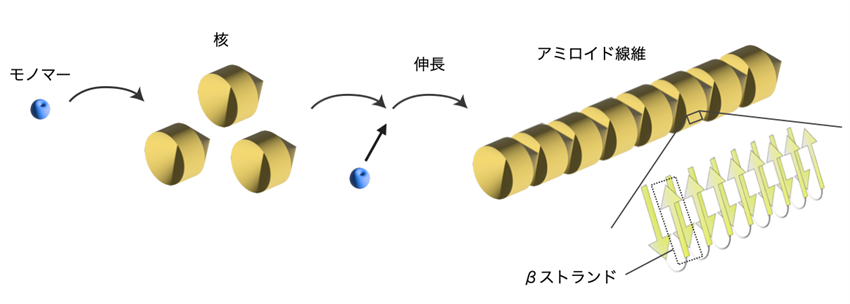 図:アミロイド線維の形成と基本構造
図:アミロイド線維の形成と基本構造
1.アミロイド線維と疾患
アミロイド線維が、体内のさまざまな組織に沈着および蓄積する病気をアミロイドーシスと呼ぶ。特に、アミロイド線維が神経細胞に沈着および蓄積する病気として神経変性疾患が知られている。クロイツフェルト・ヤコブ病やウシ海綿状脳症などのプリオン病を引き起こすプリオンタンパク質 (PrP) は、正常型 (PrPC )では α ヘリックスが豊富であるが、異常型 (PrPSc) に変換されると β シート構造に富み、アミロイド線維の形成能を得る[3][4]。プリオン病患者の脳から抽出した界面活性剤不溶性画分には、アミロイド線維が観察される[5]。
プリオン病をはじめ、現在ではアルツハイマー病 、 パーキンソン病、 ハンチントン病、筋萎縮性側索硬化症 (ALS) のような神経変性疾患は、タンパク質が凝集し、アミロイド線維を形成するという共通の病態機序を示す[6] [7]。アミロイド線維を形成するタンパク質は、疾患ごとに異なる。神経変性疾患は、脳 (神経系) に限局してアミロイドが沈着することから、限局性アミロイドーシスと呼ばれる。神経系だけでなく、複数の臓器にアミロイドが沈着する全身性のものは全身性アミロイドーシスという。このように、アミロイド線維は、異常タンパク質の凝集によって形成され、様々な臓器に沈着し、組織の機能障害をおこす。これまでに、アミロイドーシスの病態解明を目指した研究が盛んに行われている。
2.アミロイド線維の検出方法
疾患研究にスポットライトが当てられているアミロイド線維は、どのようにして検出できるのだろうか。
アミロイド線維は、チオフラビン T (ThT)[8]およびコンゴレッド (CR) [9]のようなクロス β 構造に結合する色素を用いて、 in vitro および in vivo で検出されてきた。また、 Luminescent conjugated oligothiophenes (LCO) である pFTAA などが、凝集タンパク質に結合すると特有の蛍光を発する立体構造感受性の蛍光プローブとして報告されている[10][11][12]。
原子分解能でもアミロイド線維の構造を特定できる。 Solid-state nuclear magnetic resonance (固体NMR) はアミロイドの構造研究のための強力なツールである。さまざまなアミロイド病の原因となるそれぞれのアミロイド線維は、原子レベルでの構造に共通性を持つことが固体 NMR 明らかにされている[13]。また、クライオ電子顕微鏡を用いれば、 3D 構造の線維構造を観察できるだけでなく、原子分解能でアミロイド線維の断面構造まで得ることができる[14]。原子間力顕微鏡 (Atomic Force Microscope) では、アミロイド線維形成の進行具合まで観察できる[2]。そのほか、 X 線結晶構造解析が挙げられる。アミロイド繊維は、先に述べたように、線維軸と直行して β ストランドが配列されているクロス β 構造である。この配列は、特徴的な回析パターンを示すことが知られている[15]。この回析パターンが得られるかどうかによって、ターゲットとなるタンパク質がアミロイド線維構造を形成していることを実証できる。フーリエ変換赤外分光法 (FTIR) は、クロス β をもつアミロイド線維と、天然の β シートを持つタンパク質とを識別するための手法として使われる[16]。
以上は、アミロイド線維を観察する代表的な手法であるが、組織レベルから原子レベルまでさまざまな手法が確立されている。
3.機能的なアミロイドの生理活性
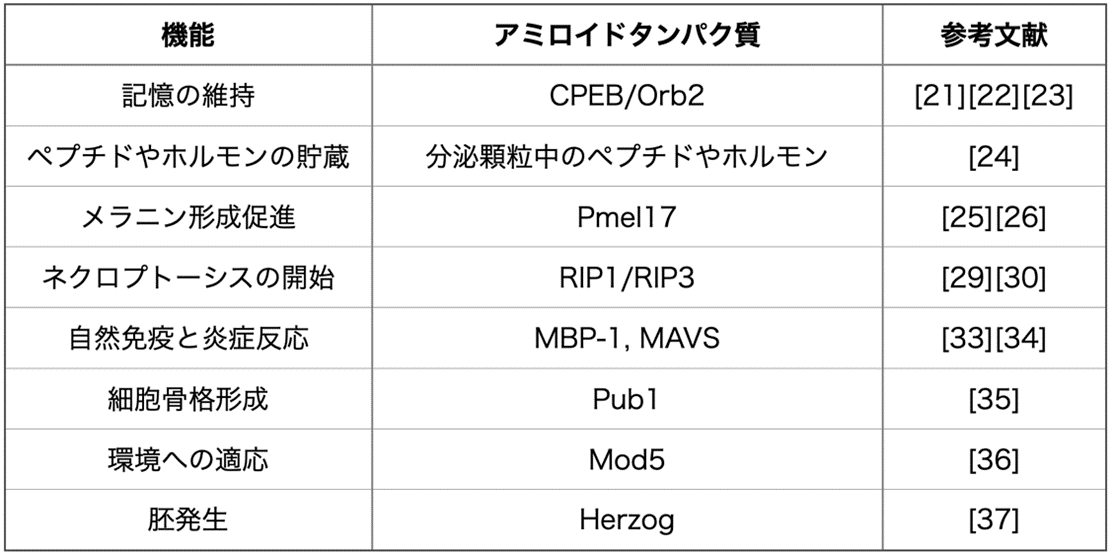 表:機能的なアミロイド
表:機能的なアミロイド
アミロイド線維は疾患と関係が深い。それはアミロイド線維が細胞内外で機能している正常な分子機構を阻害または亢進してしまう可能性があるからだと考えられる。裏を返せば、生物が営む生命現象に必要な、機能的なアミロイド線維はないのだろうか?アミロイドタンパク質には、アミロイド線維を形成しやすいグルタミンやアスパラギンに富むアミノ酸配列 (Q/Nリッチドメイン) があるものが知られており、この様な配列はプリオンドメインと呼ばれている[17]。このプリオンドメインは多くの種で保存されている。全ゲノムのタンパク質配列の解析から、出芽酵母、 分裂酵母、 シロイヌナズナ、線虫、ショウジョウバエ、ヒトでアミロイド線維を形成する可能性のあるプリオンドメインを持つタンパク質が存在することが明らかになった[18]。また、真核生物 (酵母、線虫、ショウジョウバエ) 、真正細菌、古細菌合わせて 31 種のプロテオーム配列から、プリオンドメインを探索した研究もある。この研究では、プリオンドメインは古細菌には見つからなかったが、真核生物の酵母、線虫、ショウジョウバエにおいて、それぞれのゲノムにある全タンパク質のうち 1〜3.5%の割合でプリオンドメインを持つタンパク質が特定された[19]。進化の過程で、真核生物でプリオンドメインが獲得された可能性があり、非常に興味深い。これらのように、真核生物では機能的なアミロイドが多く存在する可能性がある。本項目では、機能的なアミロイドとして報告された例を羅列する。
3-1 記憶の維持
Cytoplasmic Polyadenylation Element Binding (CPEB) タンパク質は、 RNA 結合タンパク質ファミリーの一つである[20]。アメフラシの CPEB、およびハエの CPEB 相同遺伝子、 Orb2 から形成される凝集体が長期の記憶維持に必要であることが明らかになった[21][22]。そして、 Orb2 凝集体はアミロイド線維を形成していることがクライオ電子顕微鏡で明らかにされた[23]。なお、そのアミロイド線維や核 (シード) を含む溶液に Orb2 モノマーを加えると、モノマーはアミロイド線維になる事から、 Orb2 はまさにアミロイドタンパク質の性質を持っていることがわかった。アミロイド線維の熱力学的に安定な構造は、長い間保持される必要がある長期記憶のメカニズムの鍵になるかもしれない。
3-2 ペプチドやホルモンの貯蔵
下垂体の分泌顆粒中のペプチド及びタンパク質ホルモンは、安定なアミロイド線維構造をとって貯蔵されていることが発見された[24]。この研究では、 42 個中 31 個ものペプチド・ホルモンが分泌顆粒の中で、安定な構造であるアミロイドを形成した。なお、アミロイド形成後、モノマーとしてリリースできることを in vitro で確認されており、アミロイド構造をとっているときは貯蔵状態であることが伺える。
3-3 メラニン形成促進
メラノソームは、メラニンを含む細胞小器官であり、光吸収色素である。目および皮膚に存在する網膜色素上皮細胞やメラノサイトにおいて生成される。牛の目から抽出されたメラノソームがアミロイドマーカーのチオフラビン S やコンゴレッド陽性であり、電子顕微鏡で観察すると線維状の構造体が確認された。そして、その本体がメラノソーム構成タンパク質であるPmel17であり、形成された Pmel17 アミロイド線維がメラニン合成活性を持つことが明らかにされた[25]。その後、 Pmel17 の RPT ドメイン (proline/serine/threonine-rich repeat domain) がコアとなって、凝集体がアミロイド線維に特徴的な β シート構造を持っていることが立証された[26]。メラノソームはリソソーム関連のオルガネラの一員として考えられており[27]、メラノソーム内腔は弱酸性である。実際に、酸性だと Pmel17 はアミロイド形成をし、中性だとアミロイド線維は可溶化状態になる。興味深いことに、アルツハイマー病に関わる Aβ や、パーキンソン病などのシヌクレイノパチーに関わる α - シヌクレインのアミロイド線維でもメラニン合成が進んだ[25]。これは、内在性アミロイドの機能を病的なアミロイド線維がハイジャックする可能性を示唆している。
3-4 ネクロプトーシスの開始
RIP1 および RIP3 というリン酸化酵素は、 Tumor Necrosis Factor (TNF) 誘導性のプログラムされたネクローシスの 1 つであるネクロプトーシスで中心的に働く分子である[28]。この RIP1 と RIP3 が RIP homotypic interaction motifs (RHIMs) というモチーフをコアにして、ヘテロなアミロイド線維を形成することによって、ネクロプトーシス活性の起点となることが明らかになった[29][30]。 RHIMs に I539D というアミノ酸置換の変異を誘導すると、①凝集せず、②リン酸化活性がなくなり、③ネクローシスが起こらなかった。
3-5 自然免疫と炎症反応
Eosinophil Major Basic Protein (MBP-1) は好酸球顆粒タンパク質の一つで、組織障害作用が強い。 MBP-1 は、寄生虫や細菌の膜を破壊すると考えられており[31]、自然免疫として異物に抵抗する作用がある。その一方で、喘息における気管支上皮細胞のような宿主細胞に対する MBP ‐ 1 の免疫炎症としての毒性も報告されている[32]。これら自然免疫と免疫炎症において、細胞内ではMBP-1は無毒な結晶状態であるが、細胞外に放出されると、アミロイド構造をとり、毒性を発揮することが明らかになった[33]。また、自然免疫のもう一つの例では、ミトコンドリアの膜上に存在する Mitochondrial antiviral-signaling protein (MAVS) のアミロイド様線維が、転写因子の Interferon regulatory factor 3 (IRF3) のダイマリゼーションを誘導して活性化させ、インターフェロンを誘導し、抗ウイルス作用を発揮することが報告されている[34]。この研究では、センダイウイルスに感染させた HEK293 細胞から抽出したミトコンドリア画分に MAVS が豊富に存在することが発見された。そして、ミトコンドリアに局在している MAVS タンパク質は Caspase activation and recruitment domains (CARD) というドメインを介して凝集することが明らかになった。電子顕微鏡を用いてその凝集体がアミロイド様線維であることも確認されている。
3-6 細胞骨格形成
アミロイド線維が細胞骨格の形成に必要になることも明らかになった。酵母の Pub1 は Q/N リッチなアミロイドタンパク質であり、 Sup35 とヘテロなアミロイド線維を形成する。その複合体が α Tubulin の合成に必要であることがわかった[35]。
3-7 環境への適応
アミロイド線維を形成するタンパク質は、 Q/N リッチなドメインを持つことが多い。しかし、これを持たない酵母の Mod5 というタンパク質がゲノムワイドなスクリーニングから特定された[36]。 Mod5 がアミロイド線維を形成していた株では、抗真菌性の薬剤処理でも耐性を持っていた。環境ストレスに適応するためにアミロイド線維が娘細胞へ受け継がれるという、通常の遺伝様式とは一線を画したアミロイドタンパク質の機能が示された。
3-8 胚発生
ショウジョウバエの Herzog というタンパク質はプリオン様ドメインをもっており、発生中の胚でアミロイド様の集合体を形成することが明らかになった。そして、このアミロイド様凝集体はホスファターゼ活性をもち、胚の正常な発生に関与している[37]。
以上、記憶の維持や貯蔵、分子シグナルの活性化の作用、そして発生から環境への適応まで、アミロイド線維の熱力学的に安定性を活かした機能的なアミロイド構造が関与する場面は多岐にわたる。プリオンドメインを持ったタンパク質が一定数存在すること、さらにはプリオンドメインを持たなくてもアミロイド線維を形成するタンパク質やヘテロなアミロイド線維を形成することを考慮すると、アミロイド線維は非常に多くの生命現象の関わっているのかもしれない。
4.アミロイド線維の多型
β シート構造を基本とするアミロイド線維は比較的シンプルな構造だと考えられる。にもかかわらず、アミロイド線維にはさまざまな機能があることを前項で触れた。これには、構造の多型が鍵の一つとなるだろう。出芽酵母では、アミロイドタンパク質が形成するアミロイド線維の構造多型とその機能の違いや、プリオン様伝播機構の基本原理の理解が非常に進んでいる。
翻訳終結因子タンパク質 Sup35 は、アミロイドタンパク質の一つであり、アミロイド線維を形成する[38][39]。 Sup35 のアミロイド線維を持つ[PSI+]株 は、 Sup35 が翻訳終結に関与する能力を損ない、その結果、 C 末端伸長を有するタンパク質を産生する[40][41]。 Sup35 のアミロイド線維前駆体を用いて、高効率で[PSI+]に転換させる手法が樹立され、アミロイド線維の立体構造の違いがプリオン株の表現型を決定することが 2004 年にすでに証明されている[42]。さらに、[PSI+]の表現型の違いを株の色、サイズ、凝集の数などで評価できるモデルが樹立され、多型によって生理的機能に影響が異なることが示され、断片化しやすいタイプのアミロイド線維が最もつよい伝播能力を示すということが報告された[43]。
疾患研究においても、近年では、神経変性疾患患者の脳から抽出した病原性タンパク質 (タウ、 α ‐ シヌクレインおよび TDP ‐ 43 の異常型)は、疾患ごとにアミロイド線維の多型が存在しているが明らかになってきている[44]。同一のタンパク質から多型が形成されるためにどのような因子が関与するかは不明である。しかし、細胞の種類(神経細胞やグリア細胞)、細胞環境(pHや塩濃度[45]、金属イオン[46][47]など)、補因子(脂質[48][49][50]、ヘパリンまたはヘパラン硫酸[51]、RNA[52]など)、翻訳後修飾などが、多型形成において重要な役割を果たす可能性が考えられている。
生理的にも病態機序においても、アミロイド線維の構造の違いによって、異なる機能があることが読み取れる。生物は内在的に機能的なアミロイド線維を持っていて、通常通り働いているが、疾患においては、病的なアミロイド線維がその機能をハイジャックする可能性があるのではないだろうか。
おわりに
本コラムでは、アミロイド線維について、疾患への関与から、生理的な機能まで紹介した。さらに、たった一種類のタンパク質が形成するアミロイド線維は構造多型を持ち、それらが異なる機能を発揮するということが明らかになってきている。これは、アミノ酸配列がタンパク質の立体構造を決定し、固有のタンパク機能が発揮されるという「Anfinsenのドグマ」とは一線を画したタンパク質の機能発現であり、発生から病態までつながる無数の生命現象に関与すると考えられる。
参考文献
[1] C. M. Dobson, "Protein folding and misfolding," Nature, vol. 426, no. 6968. 2003.
[2] M. Arimon et al., "Fine structure study of Aβ 1-42 fibrillogenesis with atomic force microscopy," FASEB J., vol. 19, no. 10, pp. 1344-1346, Aug. 2005.
[3] A. Kraus et al., "High-resolution structure and strain comparison of infectious mammalian prions," Mol. Cell, vol. 81, no. 21, pp. 4540-4551.e6, Nov. 2021.
[4] K. M. Pan et al., "Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins.," Proc. Natl. Acad. Sci., vol. 90, no. 23, pp. 10962-10966, Dec. 1993.
[5] P. E. Bendheim, J. M. Bockman, M. P. McKinley, D. T. Kingsbury, and S. B. Prusiner, "Scrapie and Creutzfeldt-Jakob disease prion proteins share physical properties and antigenic determinants.," Proc. Natl. Acad. Sci., vol. 82, no. 4, pp. 997-1001, Feb. 1985.
[6] C. A. Ross and M. A. Poirier, "Protein aggregation and neurodegenerative disease," Nat. Med., vol. 10, no. S7, pp. S10-S17, Jul. 2004.
[7] C. Wells, S. E. Brennan, M. Keon, and N. K. Saksena, "Prionoid Proteins in the Pathogenesis of Neurodegenerative Diseases," Front. Mol. Neurosci., vol. 12, Nov. 2019.
[8] H. LeVine, "[18] Quantification of β-sheet amyloid fibril structures with thioflavin T," 1999, pp. 274-284.
[9] W. E. Klunk, J. W. Pettegrew, and D. J. Abraham, "Quantitative evaluation of congo red binding to amyloid-like proteins with a beta-pleated sheet conformation.," J. Histochem. Cytochem., vol. 37, no. 8, pp. 1273-1281, Aug. 1989.
[10] K. P. R. Nilsson, A. Herland, P. Hammarström, and O. Inganäs, "Conjugated Polyelectrolytes: Conformation-Sensitive Optical Probes for Detection of Amyloid Fibril Formation," Biochemistry, vol. 44, no. 10, pp. 3718-3724, Mar. 2005.
[11] K. P. R. Nilsson et al., "Imaging Distinct Conformational States of Amyloid-β Fibrils in Alzheimer's Disease Using Novel Luminescent Probes," ACS Chem. Biol., vol. 2, no. 8, pp. 553-560, Aug. 2007.
[12] A. Åslund et al., "Novel Pentameric Thiophene Derivatives for in Vitro and in Vivo Optical Imaging of a Plethora of Protein Aggregates in Cerebral Amyloidoses," ACS Chem. Biol., vol. 4, no. 8, pp. 673-684, Aug. 2009.
[13] M. R. Sawaya et al., "Atomic structures of amyloid cross-β spines reveal varied steric zippers," Nature, vol. 447, no. 7143, pp. 453-457, May 2007.
[14] M. Schmidt et al., "Peptide dimer structure in an Aβ(1-42) fibril visualized with cryo-EM," Proc. Natl. Acad. Sci., vol. 112, no. 38, pp. 11858-11863, Sep. 2015.
[15] M. Sunde, L. C. Serpell, M. Bartlam, P. E. Fraser, M. B. Pepys, and C. C. . Blake, "Common core structure of amyloid fibrils by synchrotron X-ray diffraction 1 1Edited by F. E. Cohen," J. Mol. Biol., vol. 273, no. 3, pp. 729-739, Oct. 1997.
[16] G. Zandomeneghi, M. R. H. Krebs, M. G. McCammon, and M. Fändrich, "FTIR reveals structural differences between native β-sheet proteins and amyloid fibrils," Protein Sci., vol. 13, no. 12, pp. 3314-3321, Jan. 2009.
[17] R. B. Wickner, K. L. Taylor, H. K. Edskes, and M.-L. Maddelein, "Prions: Portable prion domains," Curr. Biol., vol. 10, no. 9, pp. R335-R337, May 2000.
[18] P. M. Harrison and M. Gerstein, "A method to assess compositional bias in biological sequences and its application to prion-like glutamine/asparagine-rich domains in eukaryotic proteomes ," Genome Biol., vol. 4, no. 6, p. R40, 2003.
[19] M. D. Michelitsch and J. S. Weissman, "A census of glutamine/asparagine-rich regions: Implications for their conserved function and the prediction of novel prions," Proc. Natl. Acad. Sci., vol. 97, no. 22, pp. 11910-11915, Oct. 2000.
[20] J. D. Richter and E. Klann, "Making synaptic plasticity and memory last: mechanisms of translational regulation," Genes Dev., vol. 23, no. 1, pp. 1-11, Jan. 2009.
[21] K. Si, Y.-B. Choi, E. White-Grindley, A. Majumdar, and E. R. Kandel, "Aplysia CPEB Can Form Prion-like Multimers in Sensory Neurons that Contribute to Long-Term Facilitation," Cell, vol. 140, no. 3, pp. 421-435, Feb. 2010.
[22] A. Majumdar et al., "Critical Role of Amyloid-like Oligomers of Drosophila Orb2 in the Persistence of Memory," Cell, vol. 148, no. 3, pp. 515-529, Feb. 2012.
[23] R. Hervas et al., "Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila," Science (80-. )., vol. 367, no. 6483, pp. 1230-1234, Mar. 2020.
[24] S. K. Maji et al., "Functional Amyloids As Natural Storage of Peptide Hormones in Pituitary Secretory Granules," Science (80-. )., vol. 325, no. 5938, pp. 328-332, Jul. 2009.
[25] D. M. Fowler, A. V Koulov, C. Alory-Jost, M. S. Marks, W. E. Balch, and J. W. Kelly, "Functional Amyloid Formation within Mammalian Tissue," PLoS Biol., vol. 4, no. 1, p. e6, Nov. 2005.
[26] R. P. McGlinchey, F. Shewmaker, P. McPhie, B. Monterroso, K. Thurber, and R. B. Wickner, "The repeat domain of the melanosome fibril protein Pmel17 forms the amyloid core promoting melanin synthesis," Proc. Natl. Acad. Sci., vol. 106, no. 33, pp. 13731-13736, Aug. 2009.
[27] G. Raposo, M. S. Marks, and D. F. Cutler, "Lysosome-related organelles: driving post-Golgi compartments into specialisation," Curr. Opin. Cell Biol., vol. 19, no. 4, pp. 394-401, Aug. 2007.
[28] D. Moquin and F. K.-M. Chan, "The molecular regulation of programmed necrotic cell injury," Trends Biochem. Sci., vol. 35, no. 8, pp. 434-441, Aug. 2010.
[29] J. Li et al., "The RIP1/RIP3 Necrosome Forms a Functional Amyloid Signaling Complex Required for Programmed Necrosis," Cell, vol. 150, no. 2, pp. 339-350, Jul. 2012.
[30] M. Mompeán et al., "The Structure of the Necrosome RIPK1-RIPK3 Core, a Human Hetero-Amyloid Signaling Complex," Cell, vol. 173, no. 5, pp. 1244-1253.e10, May 2018.
[31] R. Abu-Ghazaleh, G. Gleich, and F. Prendergast, "Interaction of eosinophil granule major basic protein with synthetic lipid bilayers: A mechanism for toxicity," J. Membr. Biol., vol. 128, no. 2, Jun. 1992.
[32] E. FRIGAS and G. GLEICH, "The eosinophil and the pathophysiology of asthma," J. Allergy Clin. Immunol., vol. 77, no. 4, pp. 527-537, Apr. 1986.
[33] A. Soragni et al., "Toxicity of Eosinophil MBP Is Repressed by Intracellular Crystallization and Promoted by Extracellular Aggregation," Mol. Cell, vol. 57, no. 6, pp. 1011-1021, Mar. 2015.
[34] F. Hou, L. Sun, H. Zheng, B. Skaug, Q.-X. Jiang, and Z. J. Chen, "MAVS Forms Functional Prion-like Aggregates to Activate and Propagate Antiviral Innate Immune Response," Cell, vol. 146, no. 3, pp. 448-461, Aug. 2011.
[35] X. Li, J. B. Rayman, E. R. Kandel, and I. L. Derkatch, "Functional Role of Tia1/Pub1 and Sup35 Prion Domains: Directing Protein Synthesis Machinery to the Tubulin Cytoskeleton," Mol. Cell, vol. 55, no. 2, pp. 305-318, Jul. 2014.
[36] G. Suzuki, N. Shimazu, and M. Tanaka, "A Yeast Prion, Mod5, Promotes Acquired Drug Resistance and Cell Survival Under Environmental Stress," Science (80-. )., vol. 336, no. 6079, pp. 355-359, Apr. 2012.
[37] M. F. Wangler et al., "Model organisms facilitate rare disease diagnosis and therapeutic research," Genetics, vol. 207, no. 1. Genetics Society of America, pp. 9-27, 2017.
[38] M. M. Patino, J.-J. Liu, J. R. Glover, and S. Lindquist, "Support for the Prion Hypothesis for Inheritance of a Phenotypic Trait in Yeast," Science (80-. )., vol. 273, no. 5275, pp. 622-626, Aug. 1996.
[39] S. V Paushkin, V. V Kushnirov, V. N. Smirnov, and M. D. Ter-Avanesyan, "Propagation of the yeast prion-like [psi+] determinant is mediated by oligomerization of the SUP35-encoded polypeptide chain release factor.," EMBO J., vol. 15, no. 12, pp. 3127-34, Jun. 1996.
[40] M. F. Tuite and S. L. Lindquist, "Maintenance and inheritance of yeast prions," Trends Genet., vol. 12, no. 11, pp. 467-471, Nov. 1996.
[41] M. D. Ter-Avanesyan and V. V Kushnirov, "Prions: infectious proteins with genetic properties.," Biochemistry. (Mosc)., vol. 64, no. 12, pp. 1382-90, Dec. 1999.
[42] M. Tanaka, P. Chien, N. Naber, R. Cooke, and J. S. Weissman, "Conformational variations in an infectious protein determine prion strain differences," Nature, vol. 428, no. 6980, pp. 323-328, Mar. 2004.
[43] M. Tanaka, S. R. Collins, B. H. Toyama, and J. S. Weissman, "The physical basis of how prion conformations determine strain phenotypes," Nature, vol. 442, no. 7102, pp. 585-589, Aug. 2006.
[44] A. Tarutani et al., "Ultrastructural and biochemical classification of pathogenic tau, α-synuclein and TDP-43," Acta Neuropathol., vol. 143, no. 6, pp. 613-640, Jun. 2022.
[45] W. Hoyer, T. Antony, D. Cherny, G. Heim, T. M. Jovin, and V. Subramaniam, "Dependence of α-Synuclein Aggregate Morphology on Solution Conditions," J. Mol. Biol., vol. 322, no. 2, pp. 383-393, Sep. 2002.
[46] A. Caragounis et al., "Zinc induces depletion and aggregation of endogenous TDP-43," Free Radic. Biol. Med., vol. 48, no. 9, pp. 1152-1161, May 2010.
[47] R. J. Castellani, S. L. Siedlak, G. Perry, and M. A. Smith, "Sequestration of iron by Lewy bodies in Parkinson's disease," Acta Neuropathol., vol. 100, no. 2, pp. 111-114, Aug. 2000.
[48] S. Elbaum-Garfinkle, T. Ramlall, and E. Rhoades, "The Role of the Lipid Bilayer in Tau Aggregation," Biophys. J., vol. 98, no. 11, pp. 2722-2730, Jun. 2010.
[49] L. Antonschmidt et al., "Insights into the molecular mechanism of amyloid filament formation: Segmental folding of α-synuclein on lipid membranes," Sci. Adv., vol. 7, no. 20, May 2021.
[50] W. J. Goux, S. Rodriguez, and D. R. Sparkman, "Analysis of the core components of Alzheimer paired helical filaments A gas chromatography/mass spectrometry characterization of fatty acids, carbohydrates and long-chain bases," FEBS Lett., vol. 366, no. 1, pp. 81-85, Jun. 1995.
[51] M. Goedert, R. Jakes, M. G. Spillantini, M. Hasegawa, M. J. Smith, and R. A. Crowther, "Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans," Nature, vol. 383, no. 6600, pp. 550-553, Oct. 1996.
[52] T. Kampers, P. Friedhoff, J. Biernat, E.-M. Mandelkow, and E. Mandelkow, "RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments," FEBS Lett., vol. 399, no. 3, pp. 344-349, Dec. 1996






