(2021年5月11日公開)
担当:三國 貴康 先生
所属:細胞病態学分野
背景
CRISPR-Cas9によるゲノム編集技術は、様々な生命科学および医学分野の研究に広く利用されてきている。コンベンショナルなCRISPR-Cas9はゲノムの特定の部位のDNA二重鎖を切断し、その切断部位は主に2つの内因性機構(非相同性末端結合および相同組換え修復)によって修復される1。非相同性末端結合は一定の確率で修復部位に塩基の挿入や欠失を起こすことから、フレームシフト変異による遺伝子ノックアウトによく用いられている。一方、相同組換え修復では鋳型DNAとの正確な相同組換えによって切断部位が修復されるので、鋳型DNAの配列を変化させることでゲノムに塩基の欠失、挿入あるいは置換を正確に導入することができる。このように相同組換え修復はゲノムに様々な種類の変異を正確に導入できるが、一般的にその効率が非相同性末端結合と比べて低いこと、とりわけ神経細胞のような非分裂細胞では相同組換え修復を誘導することは難しいとされてきたため、神経科学分野でのCRISPR-Cas9の応用は限られていた2。
神経科学分野の研究で相同組換え修復によるゲノム編集が行われた例として、SLENDRの開発がある(2019年5月の脳研コラム参照)3。SLENDRでは、マウスの子宮内胎児の脳に存在する神経前駆細胞(まだ分裂能を有している)に子宮内電気穿孔法でゲノム編集に必要な分子を導入することにより、個体の脳で相同組換え修復を起こすことに成功した。しかしながら、子宮内電気穿孔法を用いるSLENDRでは、胎児の脳を使用しなければならないこと、標的しにくい脳部位があること、実験によっては効率が低すぎることなどの問題点があった。
生きている個体の脳での自在なゲノム編集技術vSLENDRの開発
これまでに、アデノ随伴ウイルス(AAV)をドナー鋳型に用いた場合、相同組換えによる遺伝子組換え効率が飛躍的に向上することが報告されている4。一方、CRISPR-Cas9によるDNA二重鎖切断も、相同組換えの効率を向上させることが知られている3,5。そこで我々は、AAVベクターベースでCRISPR-Cas9を用いることで、相同組換え修復によるゲノム編集の効率を大幅に向上させることに成功した6。また、驚くべきことに、このvSLENDRのストラテジーは、分裂細胞のみならず非分裂細胞である成熟した神経細胞でも有効であった6。AAV投与は胎児から成年に至る様々な脳領域に容易に適用できるので、vSLENDRにより、あらゆる時期、細胞種、脳領域において効率よく相同組換え修復によるゲノム編集を起こせるようになった。これにより、神経科学分野でのCRISPR-Cas9の応用可能性が格段に広がり、例えば、内在性に発現するタンパク質を特異的に標識し、高精度にイメージングすることが可能になった(図1)。
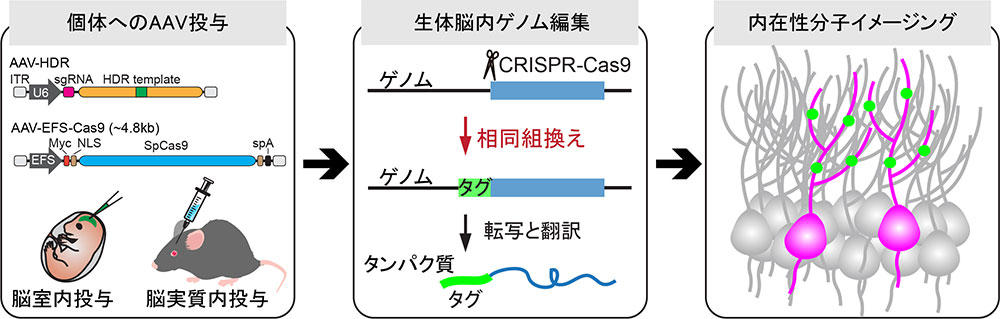
図1 vSLENDRの概要と分子イメージングへの応用
相同組換えの鋳型とガイドRNAの発現カセットを搭載したAAV(AAV-HDR)と、SpCas9の発現AAV(AAV-EFS-Cas9)を個体の脳内に投与する(左)。
投与後2週間以内に、生体脳内で相同組み換え修復によるゲノム編集を誘導できる(中)。
タグ配列を正確に挿入することで、目的の分子の局在や動態をイメージングできる(右)。
vSLENDRの応用
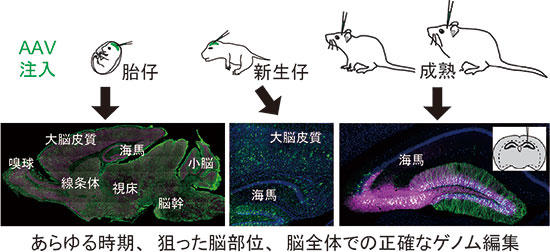
図2 任意の発達段階、狙った脳領域、脳全体で正確にゲノム編集を行う技術
ゲノム編集により特定のタンパク質を緑色で標識できる。
任意の時期の脳にウイルスを注入することで、生後2週~2ヶ月の脳全体でアクチン(左)、
大脳皮質と海馬でERK2(中)、海馬でCaMKIIα(右)を効率良く標識している。
子宮内胎仔や新生仔のAAV脳室投与により、脳全体の細胞で自在なゲノム編集ができるようになった。これにより、目的タンパク質をコードする遺伝子座にタグ配列を挿入するゲノム編集を行うことにより、AAV投与後1週間以降ならいつでも目的のタンパク質の局在を全脳レベルで解析できるようになった(図2)。また、複雑な細胞が密集している脳組織においてまばらな細胞でゲノム編集できるので、タンパク質の細胞内局在をコントラスト良く観察できる(図1, 2)。さらに、GFPなどの蛍光タンパク質で目的のタンパク質を標識することで、生きている個体のマウスの脳でタンパク質の局在や動態をイメージングできるようになった(図3)。
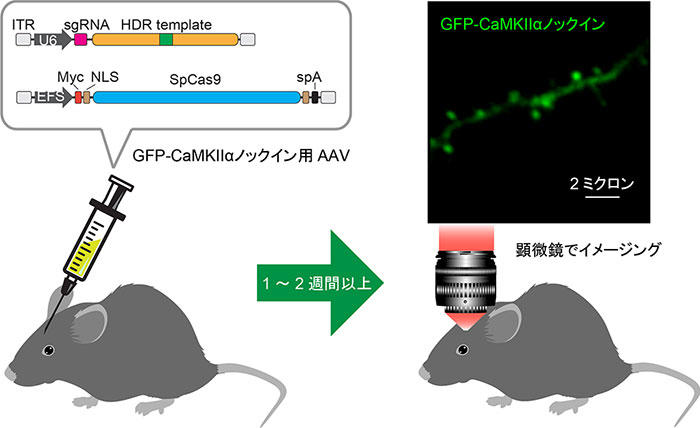
図3 内在性タンパク質の動態の生体脳内ライブイメージング
個体の脳にGFPノックイン用AAVを注入する(ここではCaMKIIαを対象にしている)。
注入後1~2週間以降に、大脳皮質で標識したタンパク質の動態を2光子顕微鏡下でin vivoイメージングできる。
文献





