(2019年5月21日公開)
担当:三國 貴康 先生
所属:細胞病態学分野
概要
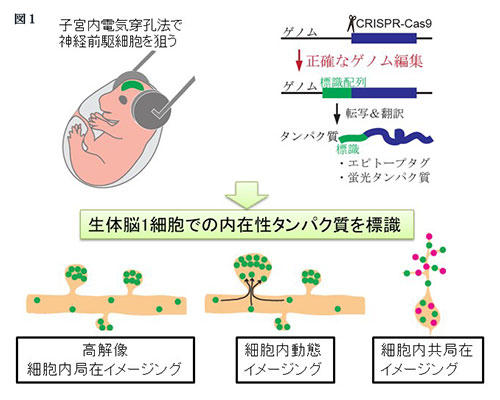 複雑な形態を示す神経細胞やグリアでは、タンパク質の細胞内局在を明らかにすることがその機能を理解するために不可欠である。本稿では、生体脳で正確なゲノム編集を行うことで内在性タンパク質を特異的に標識する技術「SLENDR法」1を紹介する。標識された内在性タンパク質を様々な顕微鏡で観察することによって、脳組織中の1細胞で、内在性タンパク質の細胞内局在を正確に、迅速に、高解像度で検出することができる(図1)。
複雑な形態を示す神経細胞やグリアでは、タンパク質の細胞内局在を明らかにすることがその機能を理解するために不可欠である。本稿では、生体脳で正確なゲノム編集を行うことで内在性タンパク質を特異的に標識する技術「SLENDR法」1を紹介する。標識された内在性タンパク質を様々な顕微鏡で観察することによって、脳組織中の1細胞で、内在性タンパク質の細胞内局在を正確に、迅速に、高解像度で検出することができる(図1)。
研究の背景
脳の機能を理解するには、脳の機能素子である細胞の機能を理解しなければならない。そのためには、機能発現の重要な担い手であるタンパク質の機能を理解することが必須である。脳細胞は、機能的にも形態的にも高度に細胞内でコンパートメント化されているため、タンパク質の機能を理解するにはその細胞内局在を高精度に可視化し同定することが重要である。脳組織は、複雑な突起を伸ばす多種多様な細胞が密に詰まっている組織であり、タンパク質の細胞内局在を詳細に解析するには、1細胞でコントラスト良くその局在を可視化することが求められる。さらに、脳細胞での機能タンパク質は数千種類もあるので、タンパク質の細胞内局在をハイスループットに同定する方法が必要である。
脳細胞でのタンパク質の局在を解析するために、これまでに様々な方法が用いられてきた。免疫組織染色は、タンパク質の局在を調べるうえで最も一般的な方法の一つである。しかしながら、目的のタンパク質に対する特異的な抗体がしばしば存在しないことや、組織中の目的タンパク質を全て認識するため1細胞でのハイコントラストな解析が困難であるという欠点がある。タグで標識したタンパク質の強制発現は、内在性タンパク質の細胞内局在と異なるパターンを示すことがあり、また、強制発現が細胞の機能に影響することもある2。従来の遺伝子組み換え技術による標識配列ノックインマウスでは、マウス作成に数ヶ月以上かかり、コストもかかる3 4。目的タンパク質を認識する抗体様プローブ(ナノボディ)を特定の細胞で発現させてタンパク質の局在を可視化する方法では、プローブの作成に時間とコストがかかり、また、適切なシグナルノイズ比を得るためにプローブの発現量を調節することが難しい5。このように、脳組織内の細胞でのタンパク質の局在を迅速、正確かつ低コストで解析する方法は従来存在しなかった。
SLENDR法による生体脳内での内在性タンパク質の標識
生体内の脳の一部の細胞において、目的のタンパク質をコードする遺伝子に標識配列を付加するようなゲノム改変操作ができれば、正確かつ迅速なタンパク質の局在観察が可能になる。私たちは、SLENDR法(single-cell labeling of endogenous proteins by CRISPR-Cas9-mediated homology-directed repair)を開発し、生体脳の1細胞で内在性タンパク質を特異的に標識し観察することを実現した1。SLENDR法の原理は、生体脳の一部の細胞で相同組換え修復による正確なゲノム編集を行い、目的遺伝子に標識配列を挿入することであり、標識された内在性タンパク質を1細胞で特異的に可視化することができる。相同組換え修復による正確なゲノム編集は主に分裂細胞で可能と考えられているため、非分裂細胞である神経細胞で正確なゲノム編集を行うことは困難とされてきた6。そこで私たちは、胎児の脳に存在する神経前駆細胞の分裂能に着目し、子宮内電気穿孔法を利用してCRISPR-Cas9によるゲノム編集に必要なコンポーネントを導入することで、生体脳で相同組換え修復による正確かつ迅速なゲノム編集を行うことに成功した。胎生10-14日齢のマウスの脳室内に、ガイドRNAとCas9を発現するプラスミドベクターと標識配列を挿入した鋳型DNA断片を注入し、電気穿孔パルスでこれらのコンストラクトを脳室周囲に存在する神経前駆細胞に導入することで、導入2日後から出生後の任意の時期において目的の内在性タンパク質の局在を可視化できるようになった(図2)。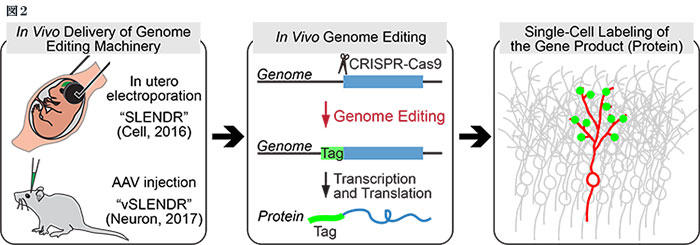
SLENDR法を用いた脳組織内での内在性タンパク質の局在・動態イメージング
1. 内在性タンパク質の細胞内局在イメージング
目的のタンパク質をコードする遺伝子にHAタグのようなエピトープ配列を挿入し、タグを特異的に認識する抗体で免疫組織染色を行うことで、脳組織内の1細胞で内在性タンパク質の局在を正確かつ迅速に観察できる。また、免疫電子顕微鏡と組み合わせることで、内在性タンパク質の局在をナノメートルレベルの高解像度で観察できる(図3)。さらに、同一細胞において2種類のタンパク質をそれぞれ異なったタグで標識することもでき、これにより2種類のタンパク質の細胞内共局在解析も可能になった。
2. 内在性タンパク質の細胞内動態イメージング
目的のタンパク質をコードする遺伝子にGFPなどの蛍光タンパク質配列を挿入し、蛍光を2光子顕微鏡などで直接観察することで、脳組織内の1細胞で内在性タンパク質の動態を正確にライブ観察できる(図3)。これにより、任意の刺激・細胞条件下で、目的の内在性タンパク質の時間的・空間的な細胞内動態を解析できる。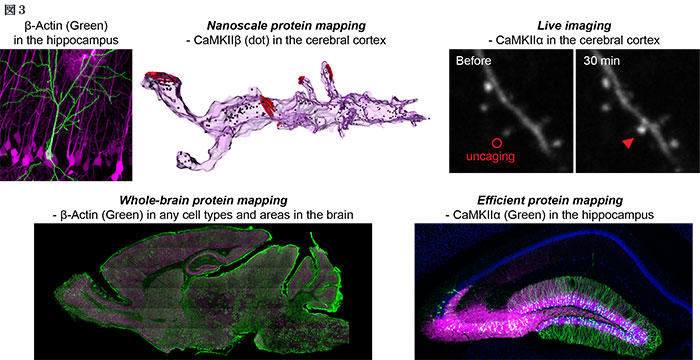
おわりに
最近私たちは、アデノ随伴ウイルスベクターとCRISPR-Cas9を組み合わせることで、マウス脳内の分裂細胞や非分裂の神経細胞において、最大30パーセントの高い効率で正確に任意の配列を挿入するゲノム編集を行うことに成功した7。この技術「vSLENDR法」を用いることで、胎生期から成熟期までのあらゆる発達段階において、生きているマウス個体の脳内のさまざまな細胞種や領域で、遺伝子配列の組み換えを正確に起こすことができる(図4)。ゆえに、このvSLENDR法の開発により、生体脳内で内在性タンパク質の局在や動態を可視化する方法がさらに充実した。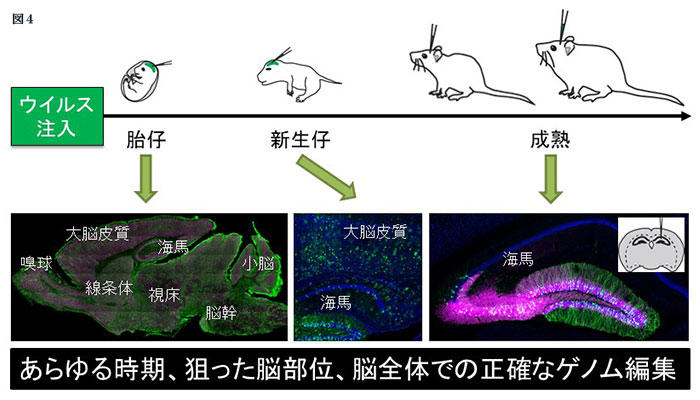
CRISPR-Cas9の認識配列はゲノム上に無数に存在するので、SLENDR法/vSLENDR法はゲノムワイドな拡張性を備えている。SLENDR法/vSLENDR法により、良い抗体がない等の理由でこれまで解析が困難であった様々なタンパク質の細胞内局在や動態を高精度に観察できるので、脳の機能のタンパク質レベルでの理解が飛躍的に進むと考えられる。
文献
1 Mikuni, T., Nishiyama, J., Sun, Y., Kamasawa, N. & Yasuda, R. High-throughput, high-resolution mapping of protein localization in mammalian brain by in vivo genome editing. Cell 165, 1803-1817, doi:10.1016/j.cell.2016.04.044 (2016).
2 El-Husseini, A. E., Schnell, E., Chetkovich, D. M., Nicoll, R. A. & Bredt, D. S. PSD-95 involvement in maturation of excitatory synapses. Science 290, 1364-1368 (2000).
3 Fortin, D. A. et al. Live imaging of endogenous PSD-95 using ENABLED: a conditional strategy to fluorescently label endogenous proteins. The Journal of neuroscience : the official journal of the Society for Neuroscience 34, 16698-16712, doi:10.1523/JNEUROSCI.3888-14.2014 (2014).
4 Yang, J. et al. Neuronal release of proBDNF. Nature neuroscience 12, 113-115, doi:10.1038/nn.2244 (2009).
5 Gross, G. G. et al. Recombinant probes for visualizing endogenous synaptic proteins in living neurons. Neuron 78, 971-985, doi:10.1016/j.neuron.2013.04.017 (2013).
6 Hsu, P. D., Lander, E. S. & Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell 157, 1262-1278, doi:10.1016/j.cell.2014.05.010 (2014).
7 Nishiyama, J., Mikuni, T. & Yasuda, R. Virus-Mediated Genome Editing via Homology-Directed Repair in Mitotic and Postmitotic Cells in Mammalian Brain. Neuron 96, 755-768, doi:10.1016/j.neuron.2017.10.004 (2017).





