(2020年5月18日公開)
担当:杉江 淳 先生
所属:脳病態解析分野
はじめに:種を超えて保存されている生命現象
地球には多種多様な生物が存在しています。それは、共通祖先から気が遠くなるような長い時を経て次第に変化して、進化してきた結果によるものです。つまり、姿形が違う生物間でも共通の生命現象が保存されていると考えることができます。例を上げると、キイロショウジョウバエを用いた研究で、ヒトを含む多くの生物が共有する生命現象が明らかにされ、ノーベル賞受賞に至ったものがあります(表1)。
表1.ノーベル賞に輝いた、キイロショウジョウバエ を用いた研究成果と研究者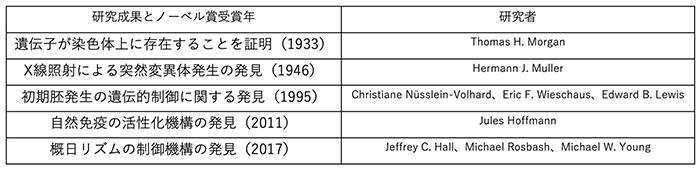
図1.キイロショウジョウバエの写真

キイロショウジョウバエはヒトとは全く見た目が違う小さな昆虫(図1)ですが、ヒトと同じ染色体やDNAをもち、胚発生に共通部分の仕組みを持ち、自然免疫もあり、体内時計も持っています。キイロショウジョウバエは、世界各地で広く見られ、日本でも家の台所などにいることがあります。そしてバルサミコ酢が好きで寄っていきます。2-3mmの大きさで2週間ほどの生活環サイクルをもち、安価に簡単に大量の個体を飼育できる点で、研究試料として使いやすく、100年以上前からモデル動物として現在も活躍をしております。このコラムでは、科学技術の進歩とともに発展してきた、ヒトの疾患に関与するキイロショウジョウバエを使った研究のこれまでとこれからを解説していきたいと思います。
ヒトの遺伝子とハエの遺伝子
ヒトは推定約21,000遺伝子、マウスは約22,000遺伝子、キイロショウジョウバエには約13,800遺伝子がゲノム上に存在します。2000年にいち早くキイロショウジョウバエのゲノムが解読され1、それまでにわかっているヒトの遺伝子との相同性が早速比較されました。その中で、Rubinらは、ヒトの疾患に関わる遺伝子として知られている289遺伝子中、61%となる177の相同遺伝子を持っていることが明らかにしました2。また、Reiterらは、キイロショウジョウバエゲノム配列に対して、Online Mendelian Inheritance in Man (OMIM)に記載されている929のヒト疾患遺伝子に対応するキイロショウジョウバエ相同遺伝子が714あり、77%の相同性を持つことを報告しています3。
近年では、キイロショウジョウバエ遺伝子とヒト遺伝子について、生存に必須な遺伝子の相同性が高いことが示されました4。この論文では、化学変異誘発剤であるEthyl Methanesulfonate(EMS)を用いて染色体にランダムに変異を導入し、それによって致死となるキイロショウジョウバエの遺伝子が大規模なスクリーニングで探索されました。その結果同定された165個の遺伝子のうち、なんと93% (153個)がヒト遺伝子と相同性をもっていました。なお、キイロショウジョウバエゲノム上の全遺伝子で比較した場合は48%の遺伝子しかヒトの相同遺伝子をもちません。以上の研究から、疾患に関わる遺伝子や生存に必要な遺伝子は、ヒトとハエの間で進化的に強く保存されていることが示唆されました。
ハエを利用したヒトの疾患研究:ヒト遺伝子をハエで発現
1970年代に遺伝子工学が勃興し、1980年代に実用化が進んでいきました。発展したその分子生物学的手法を駆使して、1990年代から2000年代初頭では、ヒトの疾患異常タンパク質をキイロショウジョウバエで発現させ、ハエでも毒性が見られることが相次いで報告されました5-8。これらはヒトとハエ間の分子メカニズムの保存性を示し、キイロショウジョウバエが疾患モデルとして利用されることになる火付け役となりました。疾患研究の例として、疾患遺伝子のタンパク質コード領域内のCAG反復の拡大により生じる疾患があります。脊髄小脳失調症3型(SCA3/MJD)は、グルタミン反復伸長により生じるヒト神経変性疾患の一つです。この伸長したポリグルタミン反復を含むヒトタンパク質がキイロショウジョウバエで発現され、ヒトと同様な核封入体を形成するだけでなく変性を起こすことが明らかになりました5。また、常染色体優性神経変性疾患であるハンチントン病の原因遺伝子ハンチンチンおいてもCAGリピートが見られます。このようにポリグルタミンで伸長したハンチンチンをキイロショウジョウバエの視神経で発現させた実験でも核内封入体を形成し、ヒト神経細胞と同様にポリグルタミン伸長ハンチンチンは神経変性を誘導しました6。さらに、黒質におけるドーパミン作動性ニューロンの消失、レビー小体の形成および運動障害を特徴とする神経変性疾患であるパーキンソン病についても、原因タンパク質α-シヌクレインをキイロショウジョウバエで発現させると、ドーパミン作動性ニューロンの消失、α-シヌクレインを含む線維状のニューロン内封入体、運動機能不全を引き起こすことが明らかになりました7。その他、アルツハイマー病に関与する微小管結合タンパク質タウをキイロショウジョウバエの脳を含む全神経で発現させることによって、進行性の神経変性が観察されることから8、21世紀をまたぐ時期には、ヒトの疾患原因遺伝子を発現させたキイロショウジョウバエモデルはヒト疾患の特徴を再現し、ポリグルタミン病やパーキンソン病、タウオパチーなど様々な神経変性疾患に対して強力な遺伝的アプローチを可能にすることを示しました。
2000年初期にはヒトやマウスゲノムが解読されました。それ以降からは、ヒトの遺伝子の機能が未知なものについて、他のモデル生物の相同遺伝子を解析することによって推測・検証することができるようになりました。疾患研究へ応用する場合は、疾患で見いだされた新たなヒト遺伝子の変異は、遺伝子の機能を欠失させてしまうのか、より活性化してしまうのかなど、どのような効果があるのか、キイロショウジョウバエを含む様々なモデル生物でその変異の効果を検討することができるようになりました。その中でキイロショウジョウバエを神経疾患モデルとして選ぶ場合に、以下の点において強みがあります。
- ゲノム中の重複遺伝子が比較的少ない→重複による遺伝子機能補償のことを強く考慮せずに遺伝子の機能を解析できる。
- 個体のサイズが小さく、安価で簡単に飼育できる→大量に研究試料として用いることができる
- 生活環サイクルが短い→迅速な遺伝学的解析ができる
- コンパクトだが脳を持っている→学習・記憶、睡眠など高次機能に必要な神経回路レベルや行動レベルでの解析が可能
これらの強みを活かして、キイロショウジョウバエは疾患研究に盛んに利用されるようになっています。たとえば、病気の原因となるタンパク質が相互作用する未知のタンパク質ネットワークを探索するために、仮説フリーの大規模な遺伝子スクリーニングを行います。次いで、候補となったネットワークメンバーの相同遺伝子をヒトゲノム中で探索して、問題となっている疾患に対するヒトの素因遺伝子となるかどうかを決定することができます。筋萎縮性側索硬化症(ALS)の疾患研究の例では、この実験パラダイムを用いたスクリーニングで、ATXN2がALSの病態に関与するということが特定された例があります9。スクリーニングで同定されたATXN2のショウジョウバエ相同遺伝子の発現を抑制とすると、TDP-43の毒性が減りました。そしてヒトのALSの脊髄でもATXN2の蓄積が見られて、ヒトの疾患に関与していることをキイロショウジョウバエのスクリーニングから明らかにできた例の一つです。
ハエを利用したヒトの疾患研究:ヒトや哺乳類で効果のある薬剤がハエにも効く?
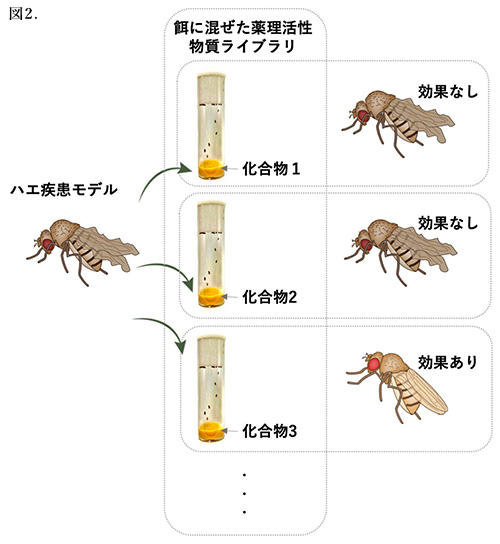
図2.ハエを利用した薬剤スクリーニング
この項では疾患に効果のある薬剤が哺乳動物だけではなくキイロショウジョウバエにも同様の効果があること、そして小さな個体であることを生かして安価な薬剤スクリーニングによる、疾患に効果のある新規薬剤を見出す可能性を秘めているということを、脆弱X症候群という神経疾患及び多発性内分泌腫瘍症を例にして解説します(図2)。
脆弱X症候群は、FMR1遺伝子機能の喪失に起因し、精神発達の異常, 学習障害から精神発達遅滞までさまざま症状が見られます。FMR1について、キイロショウジョウバエは相同遺伝子dfmr1を持っています。このdfmr1活性の喪失によって、脆弱X関連症状に類似した表現型を示すことが報告されてきました10-14。そして、哺乳類モデルで使われてきた代謝調節型グルタミン酸受容体(mGluR)アンタゴニストまたは塩化リチウム(LiCl)を経口摂取させると、dfmr1変異体で観察される表現型が緩和できることが示されました15,16。LiClはCREB DNA結合活性を促進し、GSK‐3B活性を阻害し、イノシトールトリスリン酸受容体媒介カルシウム放出を阻害することがしられています17。グループII mGluRはCREB DNA結合を減少させ、イノシトールトリスリン酸受容体媒介性カルシウム放出を増強する経路と関連しているため、LiClはこれらのmGluR効果を減少させるように作用すると考えられます。以上から、mGluRシグナル伝達の亢進が脆弱X患者で観察される認知および行動障害の根底にある原因であることをキイロショウジョウバエのdfmr1変異体でも示されました。すなわち、小さい体を生かした安価な薬剤スクリーニングによって新規薬剤候補を探索するということが可能であることが示唆されました。実際にその後、dfmr1変異体を用いて2,000化合物の化学ライブラリーを用いたスクリーニングがなされ、表現型をレスキューできる9つの化学物質が同定されました18。その中には、GABA作動性阻害経路に関与する三つの化学物質が含まれており、脆弱X症候群における興奮性経路増強のGABA作動性阻害と一致します。さらに、ムスカリン性コリン作動性受容体がGABA作動性経路と並行して脆弱X症候群において役割を果たしている可能性があることが示唆されました。以上の研究から、脆弱X症候群を治療するための薬剤開発に、キイロショウジョウバエを用いた薬剤スクリーニングによるアプローチが提言されました。
多発性内分泌腫瘍症の亜型であるMEN2Bは癌現遺伝子である受容体型チロンシンキナーゼRETの変異に起因しますが、この疾患についてキイロショウジョウバエの薬剤スクリーニングが有用であることが示された例があります。MEN2Bに関連するRET点突然変異はRET受容体チロシンキナーゼ(RTK)を活性化するため、RETキナーゼ阻害薬は、有益である可能性が高いと考えられました。そして、低分子量チロシンキナーゼ阻害剤ZD6474がマウス培養細胞株におけるRET由来癌蛋白質の酵素活性を阻害することが見出されていました19。Caganのグループは、まず2005年にヒトRET遺伝子のキナーゼドメインにある変異と同等なアミノ酸置換をキイロショウジョウバエRET相同遺伝子内で置換した変異キイロショウジョウバエRET遺伝子を発現させるキイロショウジョウバエMEN2Bモデルを開発しました20。そして同じ年にそのハエモデルにZD6474を経口投与し、このin vivoモデルで引き起こされる表現型を抑制できることを示し、幅広い種での分子メカニズムの保存性及び薬理学的効果の有用性を証明しました21,22。その後、ZD6474はVandetanibとしてMEN2患者に生じる甲状腺がんの治療に用いられる化学療法剤の一つとして2011年承認されました23。
この研究をさらに発展させ、キイロショウジョウバエMEN2Bモデルとキノーム全体の薬物プロファイリングを用いて、MEN2Bに対してより効果的でより毒性の低い化学物質の検証が行われました。キイロショウジョウバエの遺伝学と薬理学の組み合わせにより、RETのMEN2B変異によって活性化される複数の分子シグナル経路上で働くキナーゼであるRAF、SRC、mTOR、S6Kに対する活性の最適バランスを有する多重薬理効果を持つ化合物が同定されました24。
ハエを利用したヒトの疾患研究:希少疾患や未診断疾患へのシンプルなモデルの利用
全エクソームまたは全ゲノム配列決定技術を用いた個人ゲノムの配列決定における技術的進歩は、ヒト遺伝学に革命をもたらしました25。希少疾患や未診断疾患の患者のエクソームまたはゲノムを配列決定することによって、遺伝子変異が特定され、遺伝子-疾患関係の候補遺伝子座を示すことができるようになりました。そして、2014年に未診断疾患ネットワーク(UDN)26,27は米国国立衛生研究所(NIH)によって設立されました。希少・未診断疾患は文字通り稀なため、このような国家レベルでの大規模な情報共有によって初めて診断の確定を推進していくことができるようになりました。一方で、次世代シークエンサーで遺伝子の変異が見つかったとしても、これまで知られていなかった変異である場合は、果たしてその変異が疾患に関連するかの特定はできないままでした。この問題を克服し、希少・未診断のヒト疾患の診断を容易にするため、過去5年間で急速に線虫、キイロショウジョウバエ、ゼブラフィッシュなどの比較的シンプルなモデル動物の利用が進んできました。2015年には、UDNモデル生物スクリーニングセンターが設立されました。現在ではどの変異がタンパク質機能に影響するかを実験的に決定する上で、キイロショウジョウバエも重要な役割を果たしています28,29。この中で、キイロショウジョウバエのコアセンターはメンデル遺伝学センター(CMG)で同定された候補遺伝子にも取り組んでおり、単一遺伝子疾患を解決するための一助となっています25。アメリカだけでなくカナダでもRare Diseases Models & Mechanisms Netoworkというモデル動物による解析が進んでいます。
日本では、未診断疾患イニシアチブ(IRUD)というプログラムが2015年から始まっています。IRUDは、希少・未診断疾患患者に対して体系的に診断する医療システムであり、従来未診断とされていた症例に対して、全国の拠点病院および連携病院による未診断疾患の包括的診断体制、次世代シークエンサー等による遺伝子解析による診断や世界初の疾患を同定、そして臨床症状とゲノム情報を国内外で共有することにより、未診断疾患の診断確定に大きく貢献しています。その中で、絞り込まれた病因遺伝子変異候補を確定診断に結びつけるために、モデル動物等コーディネーティングネットワークによる研究を推進し、さらなる診断率向上を目指しています。ゲノム配列の解析によって見つかってくる遺伝子内の変異は、過去に同じ変異が報告されている疾患が判れば診断を下すことができます。しかし、初めて見つかる変異の場合は、その変異が疾患に関与しているのか、関与している場合は遺伝子機能にどのような影響を与えるのかすらわかっていません。ゲノム解読技術は今後も発展し、このような稀な遺伝子変異の発見はどんどん蓄積していくことが予想されます。まだ候補の状態である遺伝子変異がどのような効果をもたらすのか、ヒトに近く最も疾患研究に利用されている哺乳類モデルですべてを進めていくのは研究費用と費やす時間を考えると現実的ではありません。キイロショウジョウバエを含むシンプルなモデル生物は、これらの問題を解決するためにまさにうってつけだと考えられます。例えば、大量に見つかっている遺伝子変異候補をそれぞれすべてキイロショウジョウバエで発現させ、その変異の効果を検証できます。異常があった候補に対して、それらを哺乳類モデルでの解析につなげることや、人への診断に貢献することが迅速できると考えられます(図3)。またこの時に、異常が見つからなかった候補は疾患に関係ない可能性が示唆できることも重要です。
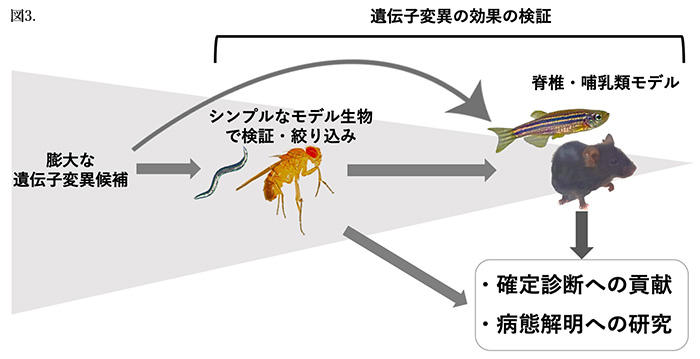
図3.希少・未診断疾患の診断確定へ貢献するためのモデル生物の利用
さいごに:研究室や研究分野の垣根を超えたネットワークで進める疾患研究
前項で解説したように、希少・未診断疾患の診断のためのシンプルなモデル生物の利用が近年世界中で広がっています。それは、臨床研究者と様々なモデル生物研究者間のネットワーク形成を可能とした大型プログラムが始まったからだと言えます。この流れに乗って今後ますます、疾患研究に対してヒトに近いモデルから時間と費用と手間がかからないシンプルなモデルでの研究それぞれの強みを適切に活かし、臨床研究者と様々なモデル生物研究者間がチームとなって統合的に推進していくスタイルがより活発になっていくと考えられます。それの一助となるのがネットワーク環境の向上です。近年通信システムの爆発的な発達が進み、今後さらに臨床研究者と様々なモデル生物研究者間の意思疎通が容易になると考えられます。また、現在私達は新型コロナウイルス感染症(COVID-19)の影響により、リモートワークの急速な普及が強いられています。そのため、研究室や研究分野の垣根を超えてチームとして研究を進める環境がより整っていくのではないかと考えられます。
参考文献
-
Adams, M. D. et al. The genome sequence of Drosophila melanogaster. Science 287, 2185-2195 (2000).
-
Rubin, G. M. et al. Comparative genomics of the eukaryotes. Science 287, 2204-2215 (2000).
-
Reiter, L. T., Potocki, L., Chien, S., Gribskov, M. & Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
-
Yamamoto, S. et al. A drosophila genetic resource of mutants to study mechanisms underlying human genetic diseases. Cell 159, 200-214 (2014).
-
Warrick, J. M. et al. Expanded polyglutamine protein forms nuclear inclusions and causes neural degeneration in Drosophila. Cell 93, 939-949 (1998).
-
Jackson, G. R. et al. Polyglutamine-expanded human huntingtin transgenes induce degeneration of Drosophila photoreceptor neurons. Neuron 21, 633-642 (1998).
-
Feany, M. B. & Bender, W. W. A Drosophila model of Parkinson's disease. Nature 404, 394-398 (2000).
-
Wittmann, C. W. et al. Tauopathy in Drosophila: Neurodegeneration without neurofibrillary tangles. Science (80-. ). 293, 711-714 (2001).
-
Elden, A. C. et al. Ataxin-2 intermediate-length polyglutamine expansions are associated with increased risk for ALS. Nature 466, 1069-75 (2010).
-
Wan, L., Dockendorff, T. C., Jongens, T. A. & Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol. Cell. Biol. 20, 8536-47 (2000).
-
Dockendorff, T. C. et al. Drosophila lacking dfmr1 activity show defects in circadian output and fail to maintain courtship interest. Neuron 34, 973-984 (2002).
-
Lee, A. et al. Control of dendritic development by the Drosophila fragile X-related gene involves the small GTPase Rac1. Development 130, 5543-5552 (2003).
-
Morales, J. et al. Drosophila fragile X protein DFXR regulates neuronal morphology and function in the brain. Neuron 34, 961-972 (2002).
-
Zhang, Y. Q. et al. Drosophila fragile x-related gene regulates the MAP1B homolog Futsch to control synaptic structure and function. Cell 107, 591-603 (2001).
-
McBride, S. M. J. et al. Pharmacological rescue of synaptic plasticity, courtship behavior, and mushroom body defects in a Drosophila model of Fragile X syndrome. Neuron 45, 753-764 (2005).
-
McBride, S. M. J., Holloway, S. L. & Jongens, T. A. Using Drosophila as a tool to identify pharmacological therapies for fragile X syndrome. Drug Discovery Today: Technologies 10, (2013).
-
Grimes, C. A. & Jope, R. S. CREB DNA binding activity is inhibited by glycogen synthase kinase-3 beta and facilitated by lithium. J. Neurochem. 78, 1219-32 (2001).
-
Chang, S. et al. Identification of small molecules rescuing fragile X syndrome phenotypes in Drosophila. Nat. Chem. Biol. 4, 256-263 (2008).
-
Carlomagno, F. et al. ZD6474, an orally available inhibitor of KDR tyrosine kinase activity, efficiently blocks oncogenic RET kinases. Cancer Res. 62, 7284-7290 (2002).
-
Read, R. D. et al. A drosophila model of multiple endocrine neoplasia type 2. Genetics 171, 1057-1081 (2005).
-
Vidal, M., Wells, S., Ryan, A. & Cagan, R. ZD6474 suppresses oncogenic RET isoforms in a Drosophila model for type 2 multiple endocrine neoplasia syndromes and papillary thyroid carcinoma. Cancer Res. 65, 3538-3541 (2005).
-
Das, T. & Cagan, R. Drosophila as a novel therapeutic discovery tool for thyroid cancer. Thyroid : official journal of the American Thyroid Association 20, 689-695 (2010).
-
Wells, S. A. et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: A randomized, double-blind phase III trial. J. Clin. Oncol. 30, 134-141 (2012).
-
Dar, A. C., Das, T. K., Shokat, K. M. & Cagan, R. L. Chemical genetic discovery of targets and anti-targets for cancer polypharmacology. Nature 486, 80-84 (2012).
-
Posey, J. E. et al. Insights into genetics, human biology and disease gleaned from family based genomic studies. Genetics in Medicine 21, 798-812 (2019).
-
Ramoni, R. B. et al. The Undiagnosed Diseases Network: Accelerating Discovery about Health and Disease. American Journal of Human Genetics 100, 185-192 (2017).
-
Splinter, K. et al. Effect of genetic diagnosis on patients with previously undiagnosed disease. N. Engl. J. Med. 379, 2131-2139 (2018).
-
Wangler, M. F. et al. Model organisms facilitate rare disease diagnosis and therapeutic research. Genetics 207, 9-27 (2017).
-
Bellen, H. J., Wangler, M. F. & Yamamoto, S. The fruit fly at the interface of diagnosis and pathogenic mechanisms of rare and common human diseases. Human Molecular Genetics 28, R207-R214 (2019).





