遺伝性脳小血管病に対するカンデサルタンの有効性を確認 - 脳動脈硬化の新たな治療法として期待 -
2021年11月16日
概要
本研究所分子神経疾患資源解析学分野の加藤泰介准教授、同脳神経内科学分野の小野寺理教授、理化学研究所生命医科学研究センター応用ゲノム解析技術研究チームの眞鍋理一郎上級研究員らの研究グループは、遺伝性の脳小血管病(※1)の一つである、CARASIL(皮質下梗塞と白質脳症を伴う常染色体劣性遺伝性脳動脈硬化症)が、matrisomeタンパク質(※2)の蓄積による加齢性の血管線維化によって発症するという新たな分子メカニズムを発見し、抗線維化剤であるカンデサルタン(※3)の投与によって、CARASILモデルマウスの脳血管機能障害が治療可能であることを発見しました。本研究成果は、今後の脳小血管病に対する治療法開発の基盤になることが期待されます。
研究成果のポイント
- CARASILモデルマウス、CARASIL患者では、血管の内膜でmatrisomeが蓄積していました。
- CARASILモデルマウスでは、matrisome蓄積による血管の硬化と脳血流の低下が認められました。
- カンデサルタンによるmatrisomeタンパク質の蓄積抑制によって、血管機能を改善できることを発見しました。
Ⅰ.研究の背景
脳小血管病は、加齢や高血圧に伴って、脳の細い動脈(脳小動脈)が硬化し、歩行障害や認知症を来す疾患です。高齢者には、程度の差こそあれ、よく認められます。しかし、その有効な治療方法は見出されていません。常染色体劣性遺伝形式(※4)の脳小動脈硬化症を引き起こすCARASILは、セリンプロテアーゼ(※5)であるhigh-temperature requirement serine peptidase A1(以下、HTRA1)の異常によって起こり、20-30代で発症し、40代には自力歩行が難しくなり、重度の認知症を来します。またヘテロ接合体(※6)でも50代過ぎに発症することが知られています。イギリスでは450人に1人が、HTRA1の遺伝子に問題となる変異を持っているとされ、この変異が脳小動脈硬化によって生じる脳白質異常と関係が示されたことにより、HTRA1の機能障害と脳小血管病との関連が注目されています。日本においても、まだ多くHTRA1の異常と関連する症例が見逃されていると考えられています。
CARASIL脳血管症の特徴は、血管平滑筋細胞の脱落と血管内膜の線維化による肥厚、そして血管弾性板の多層化で、これらの病理学的所見は、高血圧や糖尿病などの血管リスク因子が原因となる、非遺伝性の脳小血管病患者と類似しており、両者の背景には、共通の分子機序の存在が疑われています。CARASILでは高血圧、糖尿病といったリスク因子を伴わず、なぜHTRA1機能の低下が脳小血管病を発症させるのか、その分子機序は不明でした。
近年、加齢による組織線維化と呼ばれる現象と、各臓器における老化に伴う機能不全との関わりが注目されています。線維化は加齢や疾患に応じた細胞外環境の変化であり、分子的には細胞外環境を形成する、matrisomeと呼ばれる、細胞外マトリクス(extracellular matrix: ECM)とECM結合性タンパク質で構成されるタンパク質群の会合を伴う蓄積を認めます。
本研究グループは、CARASIL脳血管に高度な線維化が認められること、また、発症に加齢が関与していることから、本症の分子メカニズムにmatrisome恒常性の異常が関与しているのではないかと仮説を立て、これを検証しました。
Ⅱ.研究の概要・成果
要約
今回、本研究グループは質量分析法を用いた網羅的な定量的プロテオーム解析から、CARASILモデルマウスであるHTRA1遺伝子欠損マウス(HTRA1−/−マウス)では、ECMタンパク質を主体とするmatrisomeの恒常性が失われ、脳血管内膜にmatrisomeタンパク質蓄積による線維性の肥厚が発生することを突き止めました。このmatrisomeタンパク質の蓄積を、カンデサルタンの投与によって抑制することにより、HTRA1−/−マウスで起こる血管内膜肥厚、血管構造異常、血管硬化、そして脳血流低下といった脳小血管病病態が治療可能であることを発見しました。この研究から、本研究グループは、これまで分子機構が不明であり治療法のなかった脳小血管病に対して、matrisomeを標的とした抗線維化という新たな治療法開発の可能性を示しました。
本文
まず、本研究グループは、加齢に沿った、CARASILのモデルマウスであるHTRA1遺伝子欠損マウス(HTRA1−/−マウス)脳血管の構造学的解析を実施しました。解析は、CARASIL患者で変性が強くみられる、脳表軟膜血管を用いて行いました。その結果HTRA1−/−マウスは、高齢期において、患者類似の血管拡張性変化と非細胞性の血管内膜の肥厚を呈することを見出しました。この肥厚層は、血管内皮細胞層と内弾性板との間に、血管全周性に形成されていることを電子顕微鏡観察によって見出しました。肥厚層は、ECMタンパク質であるエラスチン線維で形成される内弾性板と融合しており、電子顕微鏡観察の結果、内弾性板層よりもさらに分子密度の高い線維層が形成されているものと考えられました。この肥厚層の形成は、内弾性板を伴う脳実質内細動脈にまで及んでいました。
次に、この肥厚部に蓄積するタンパク質を同定するため、高齢期のマウス軟膜血管を用いた、網羅的なタンパク質定量プロファイリング解析を質量分析法によって実施しました。その結果、HTRA1−/−マウスでは389種の増加タンパク質が見出され、一方で減少タンパク質はわずか27種のみであり、HTRA1−/−マウスで起こるタンパク質変化は、圧倒的に増加性変化であることが示されました。この増加タンパク質が、どのようなタンパク質種で構成されているかを、質量分析データを用いたgene-ontologyエンリッチメント解析(※7)によって統計学的に解析した結果、HTRA1−/−マウスで増加するタンパク質は、明らかにECMタンパク質群に偏った構成であることが示され、実に40%のタンパク質がECMタンパク質を主体とする、matrisomeタンパク質に属するタンパク質であることが分かりました(図1a)。HTRA1−/−マウスで増加していたmatrisomeタンパク質をタンパク質相互作用(protein-protein interaction network: PPi network)解析法で解析した結果、HTRA1の分解基質として知られるfibronectin (FN)が蓄積matrisome内のハブタンパク質として機能していることが示されました。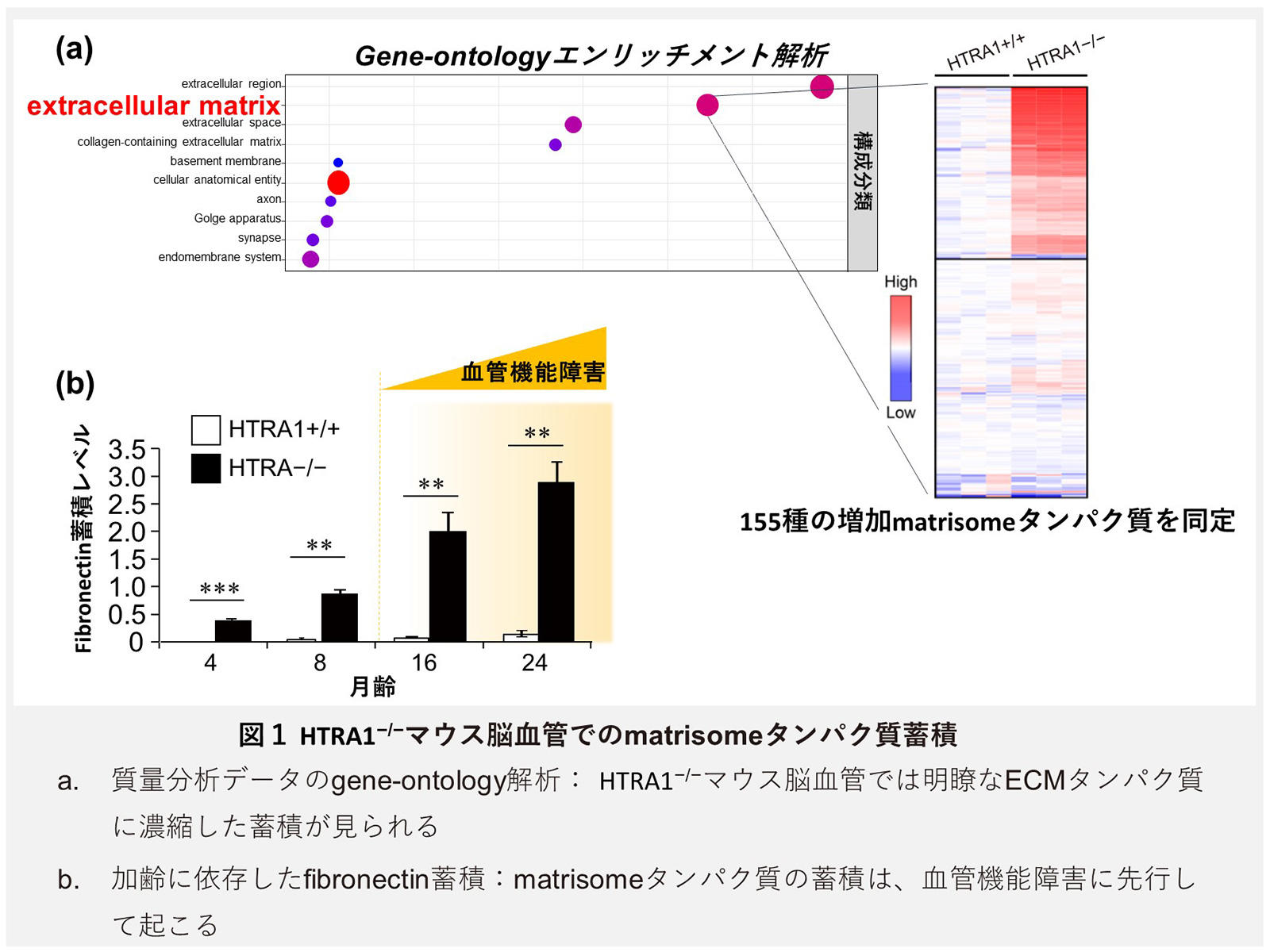 次に、FNや内弾性板新生誘導因子であるLTBP-4などを含む、HTRA1−/−マウスで特に増加が顕著であったmatrisomタンパク質を組織学的に解析した結果、いずれのタンパク質も肥厚が観察された血管内皮細胞層下に蓄積すること、また、肥厚内膜内には異所性の内弾性板新生が誘導されており、CARASIL患者で認められるような内弾性板の多層化が確認されました。重要な点として、これらのmatrisomeの蓄積は、高齢期に観察された血管構造変化よりも、先行して起きており、加齢に伴って顕著に蓄積具合が増加することが明らかとなりました(図1b)。さらに、matrisomeタンパク質の蓄積は、肥厚が観察された軟膜血管と脳実質細動脈に限局したものであり、さらに細い血管単位である毛細血管では起こらないことが分かりました。この血管径に依存したmatrisomeの蓄積は、血管内皮細胞によるHTRA1の発現と、ほぼ一致しており、matrisomeタンパク質の蓄積は、血管内皮細胞由来のHTRA1による分解制御の低下が原因であることが、in situ hybridization解析によって示唆されました。このようなmatrisomの蓄積は、実際のCARASIL患者脳血管の内膜線維肥厚層においても、同様に起こっていることが、剖検脳を用いた解析から確認されました。
次に、FNや内弾性板新生誘導因子であるLTBP-4などを含む、HTRA1−/−マウスで特に増加が顕著であったmatrisomタンパク質を組織学的に解析した結果、いずれのタンパク質も肥厚が観察された血管内皮細胞層下に蓄積すること、また、肥厚内膜内には異所性の内弾性板新生が誘導されており、CARASIL患者で認められるような内弾性板の多層化が確認されました。重要な点として、これらのmatrisomeの蓄積は、高齢期に観察された血管構造変化よりも、先行して起きており、加齢に伴って顕著に蓄積具合が増加することが明らかとなりました(図1b)。さらに、matrisomeタンパク質の蓄積は、肥厚が観察された軟膜血管と脳実質細動脈に限局したものであり、さらに細い血管単位である毛細血管では起こらないことが分かりました。この血管径に依存したmatrisomeの蓄積は、血管内皮細胞によるHTRA1の発現と、ほぼ一致しており、matrisomeタンパク質の蓄積は、血管内皮細胞由来のHTRA1による分解制御の低下が原因であることが、in situ hybridization解析によって示唆されました。このようなmatrisomの蓄積は、実際のCARASIL患者脳血管の内膜線維肥厚層においても、同様に起こっていることが、剖検脳を用いた解析から確認されました。
血管線維化は、組織の物理的な柔軟性を低下させ、組織機能障害の原因となることが知られています。本研究グループは、HTRA1−/−マウス脳血管でも、matrisomeの蓄積による血管線維化による硬化が起こっているかを、pressure myography法を用いて解析しました(図2a)。解析の結果、HTRA1−/−マウスの脳血管では、同齢の野生型マウス(HTRA1+/+マウス)と比較して、血管内圧変化に対する血管伸展性の低下が見られ、血管の硬化が進行していることが確認されました(図2a, b)。さらに、本研究グループは、血管硬化の結果、HTRA1−/−マウスの脳血流量が低下していることを、MRI(磁気共鳴画像)を用いた解析によって発見しました(図2c, d)。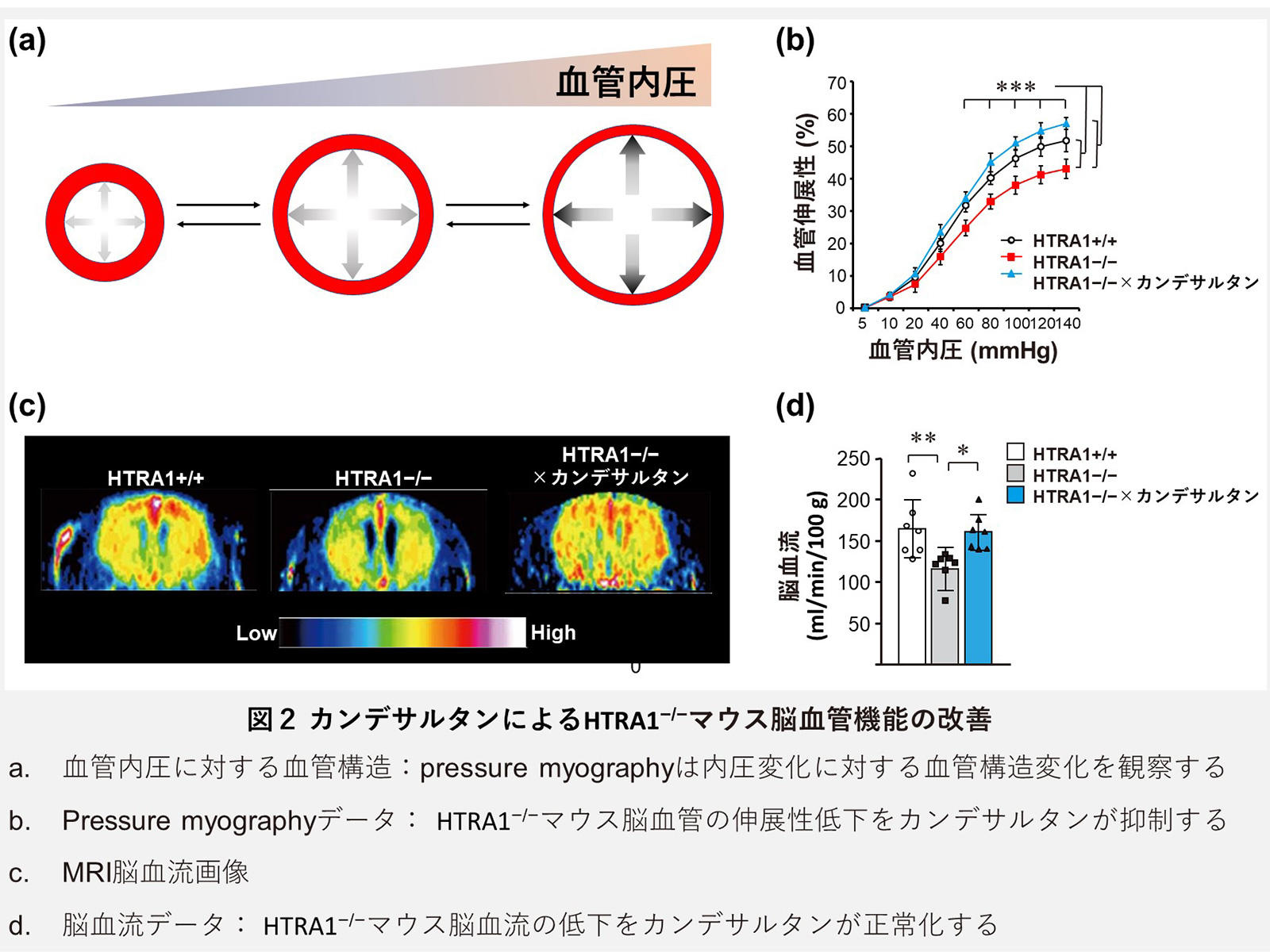 この血管内膜の肥厚線維化を引き起こすmatrisomeタンパク質の原因が、本症の原因であり、治療標的となり得ると想定した本研究グループは、次に、ECMタンパク質蓄積による組織線維化、特にFN線維化形成を阻害することで知られるカンデサルタンを投与し、その治療効果の検証を行いました。カンデサルタンの投与は、matrisomeタンパク質の蓄積が始まる4ヵ月齢から開始し、脳小血管病病態が発症する高齢期(20ヵ月齢~)に、その効果を評価しました。まず、蓄積が顕著であったmatrisomeタンパク質を対象に、組織学的、生化学的な解析を行った結果、カンデサルタンの投与を受けたHTRA1−/−マウス脳血管では、いずれのmatrisomeタンパク質においても蓄積の低下が認められました(図3a)。
この血管内膜の肥厚線維化を引き起こすmatrisomeタンパク質の原因が、本症の原因であり、治療標的となり得ると想定した本研究グループは、次に、ECMタンパク質蓄積による組織線維化、特にFN線維化形成を阻害することで知られるカンデサルタンを投与し、その治療効果の検証を行いました。カンデサルタンの投与は、matrisomeタンパク質の蓄積が始まる4ヵ月齢から開始し、脳小血管病病態が発症する高齢期(20ヵ月齢~)に、その効果を評価しました。まず、蓄積が顕著であったmatrisomeタンパク質を対象に、組織学的、生化学的な解析を行った結果、カンデサルタンの投与を受けたHTRA1−/−マウス脳血管では、いずれのmatrisomeタンパク質においても蓄積の低下が認められました(図3a)。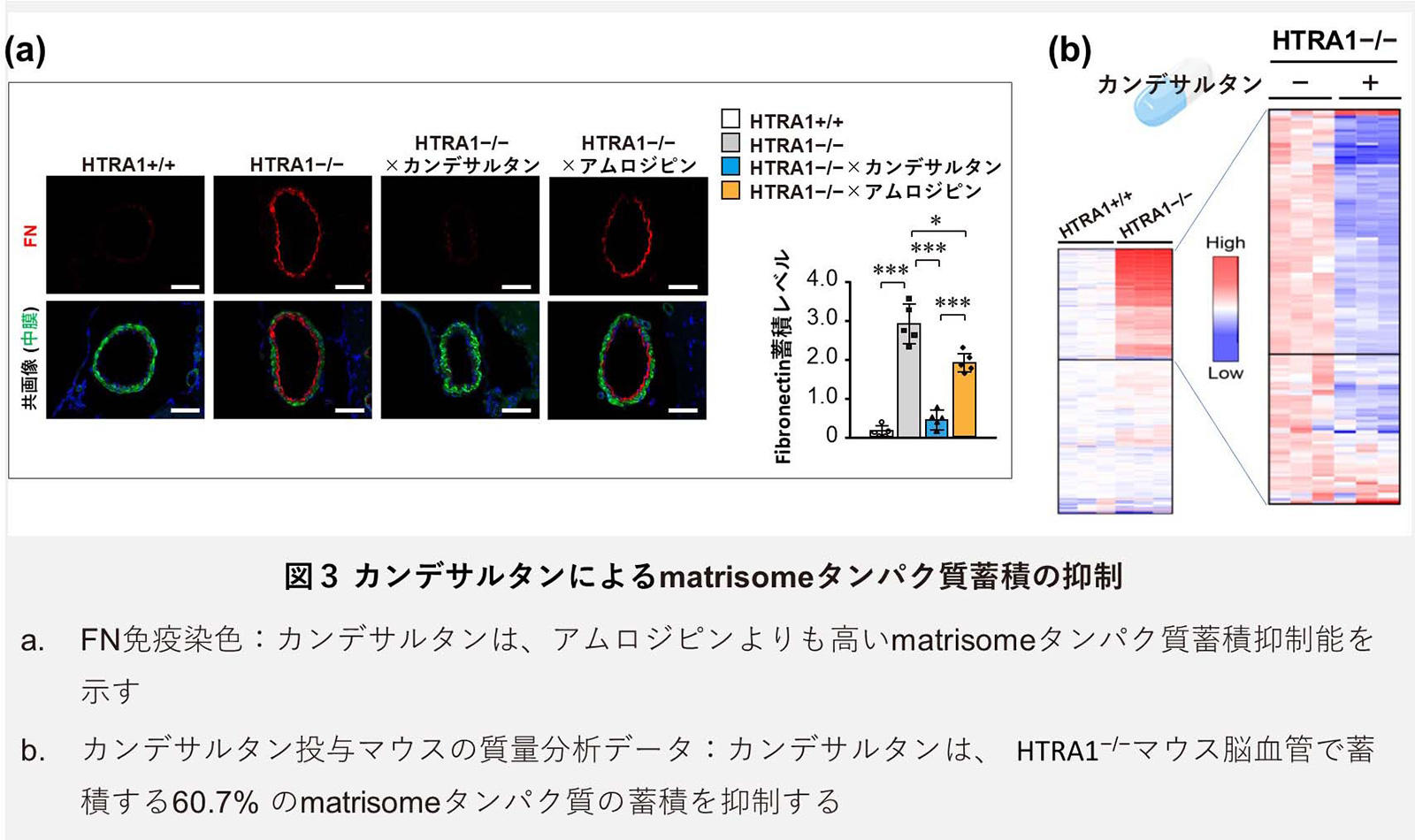 カンデサルタンは高血圧治療薬として臨床使用されていることから、このmatrisome蓄積抑制効果が、カンデサルタンの降圧効果を介した結果であるかを確かめるため、異なる降圧作用機構を有する、アムロジピン(カルシウム拮抗薬)を同様に投与し、比較検証しました。結果、同程度の降圧効果を示すアムロジピン投与であっても、カンデサルタンのほうが、有意にmatrisomeタンパク質蓄積抑制効果が高いことを見出し(図3a)、さらに、病理学的な解析から、HTRA1−/−マウス脳血管の血管拡張、並びに血管内膜肥厚変化に対して、カンデサルタンのみが抑制効果を発揮することを明らかとしました。この結果は、カンデサルタンが降圧作用とは独立した機構によって、matrisome蓄積を抑制する作用を有していることを示しています。また、カンデサルタンを投与したHTRA1−/−マウスサンプルにおいても、質量分析解析を実施し、その結果、60%におよぶmatrisomeタンパク質の蓄積を軽減していることが分かりました(図3b)。この結果は、HTRA1−/−マウスのECMタンパク質増加に対して、カンデサルタンが非常に効果的な抑制機能を発揮したことを示しています。さらに、本研究グループは、カンデサルタンの投与によってHTRA1−/−マウスの血管の硬化が改善し、脳血流低下が正常化することを明らかにし、matrisomeによる血管の線維化抑制が、血管機能異常を改善し得ることを証明しました(図2a-d)。
カンデサルタンは高血圧治療薬として臨床使用されていることから、このmatrisome蓄積抑制効果が、カンデサルタンの降圧効果を介した結果であるかを確かめるため、異なる降圧作用機構を有する、アムロジピン(カルシウム拮抗薬)を同様に投与し、比較検証しました。結果、同程度の降圧効果を示すアムロジピン投与であっても、カンデサルタンのほうが、有意にmatrisomeタンパク質蓄積抑制効果が高いことを見出し(図3a)、さらに、病理学的な解析から、HTRA1−/−マウス脳血管の血管拡張、並びに血管内膜肥厚変化に対して、カンデサルタンのみが抑制効果を発揮することを明らかとしました。この結果は、カンデサルタンが降圧作用とは独立した機構によって、matrisome蓄積を抑制する作用を有していることを示しています。また、カンデサルタンを投与したHTRA1−/−マウスサンプルにおいても、質量分析解析を実施し、その結果、60%におよぶmatrisomeタンパク質の蓄積を軽減していることが分かりました(図3b)。この結果は、HTRA1−/−マウスのECMタンパク質増加に対して、カンデサルタンが非常に効果的な抑制機能を発揮したことを示しています。さらに、本研究グループは、カンデサルタンの投与によってHTRA1−/−マウスの血管の硬化が改善し、脳血流低下が正常化することを明らかにし、matrisomeによる血管の線維化抑制が、血管機能異常を改善し得ることを証明しました(図2a-d)。
Matrisome蓄積による線維化機構の一方で、CARASILではTGF-βシグナル(※8)の異常が関与していることが指摘されてきました。しかし、シグナル解析、下流遺伝発現解析、いずれにおいても、HTRA1−/−マウス脳血管でTGF-βシグナルの変動は認められませんでした。また本研究グループは、RNAシーケンス解析(※9)による網羅的解析と、高感度な単一遺伝子毎の発現解析法を組み合わせ、遺伝子発現の詳細な解析を実施しました。その結果、カンデサルタンはHTRA1−/−マウス脳血管内で、元来起こっている遺伝子発現変化に対して影響を与えない一方で、FNやLTBP-4などのmatrisome遺伝子の発現を抑制する効果を持つことが分かりました。さらに、本研究グループは、カンデサルタンが、ECM線維化促進因子であるAdamtsl2の発現を、非常に強く抑制する効果を持つことを発見しました。Adamtsl2遺伝子欠損マウスでは、FNを含むECMの蓄積が低下することが知られており、この遺伝子発現抑制効果は、カンデサルタンによる抗線維化作用の重要な介在因子である可能性が考えられます。
これらの結果から、HTRA1−/−マウスが示す脳小血管病病態の分子機序の主体は、matrisomeタンパク質蓄積による脳血管線維化であり、カンデサルタンによる治療効果はmatrisome蓄積抑制による抗線維化によってなされていることが実証されました(図4)。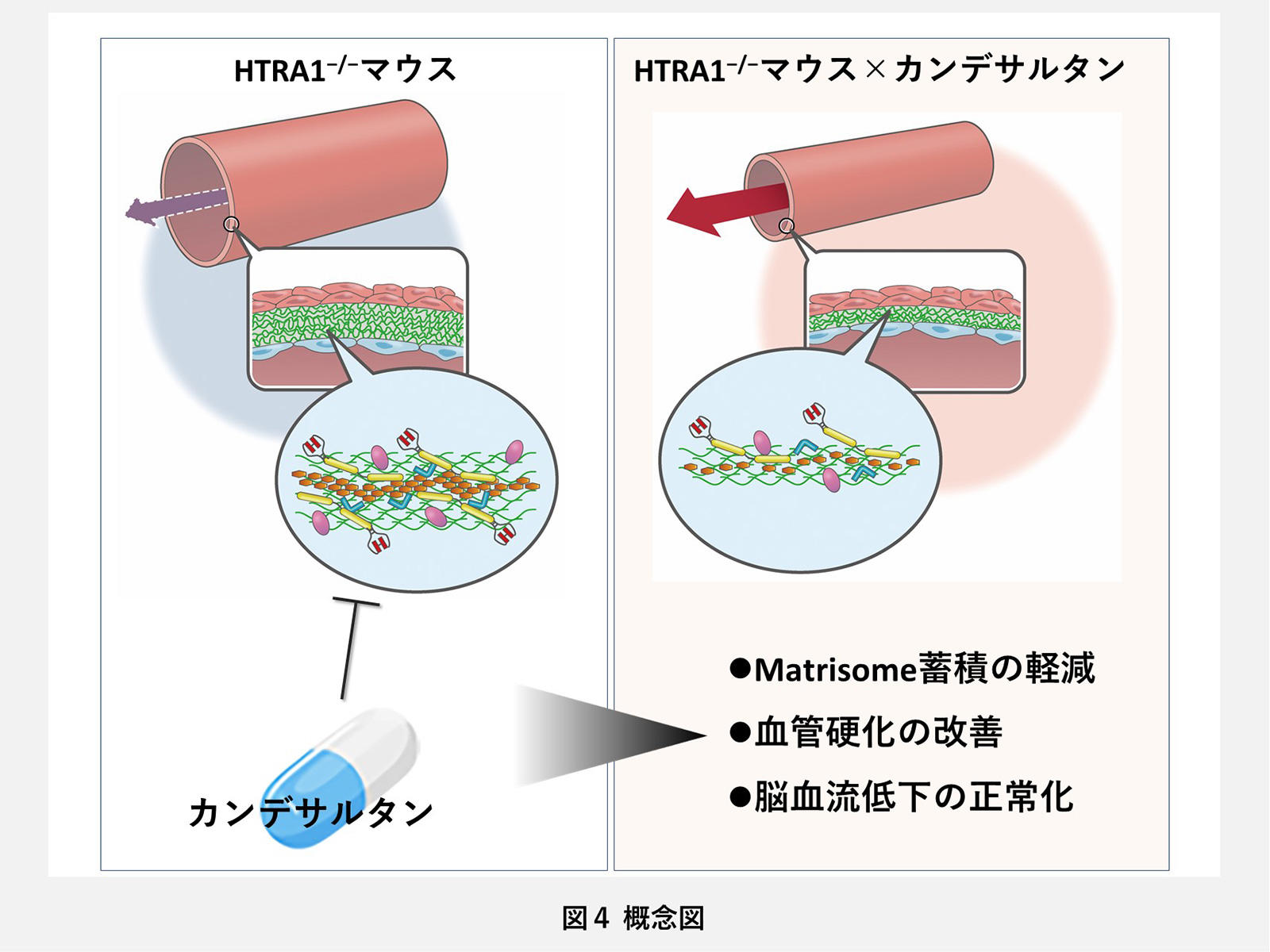
Ⅲ.今後の展開
本研究により、CARASILはmatrisomeの異常によって発症することが示され、その治療薬にはカンデサルタンが有力になり得ることが示されました。CARASILで認められる動脈の変化は、加齢性の脳小動脈硬化症に類似し、CARASILでもFNの蓄積が報告されています。今後、matrisomeの調節を通した、脳小動脈硬化の進行を抑制・緩和するという、これまでにない治療コンセプトをより幅広い疾患に応用できる可能性があります。
Ⅳ.研究成果の公表
本研究成果は、2021年11月15日正午(米国東部時間)、科学雑誌「Journal of Clinical Investigation」誌に掲載されました。
| 【論文タイトル】 | Candesartan prevents arteriopathy progression in cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy model. |
| 【著者】 | Taisuke Kato, Ri-ichiroh Manabe, Hironaka Igarashi, Fuyuki Kametani, Sachiko Hirokawa, Yumi Sekine, Natsumi Fujita, Satoshi Saito, Yusuke Kawashima, Yuya Hatano, Shoichiro Ando, Hiroaki Nozaki, Akihiro Sugai, Masahiro Uemura, Masaki Fukunaga, Toshiya Sato, Akihide Koyama, Rie Saito, Atsushi Sugie, Yasuko Toyoshima, Hirotoshi Kawata, Shigeo Murayama, Masaki Matsumoto, Akiyoshi Kakita, Masato Hasegawa, Masafumi Ihara, Masato Kanazawa, Masatoyo Nishizawa, Shoji Tsuji, and Osamu Onodera |
| 【doi】 | 10.1172/JCI140555 |
Ⅴ.本研究への支援
本研究は、文部科学省科学研究費補助金 新学術領域研究「脳タンパク質老化と認知症制御」、日本医療研究開発機構(AMED)「難治性疾患実用化研究事業:薬事承認を目指すシーズ探索研究 (ステップ0)」、日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム(脳プロ)」、日本学術振興会 科学研究費助成事業 基盤研究 (A)、若手研究 (B)、日本学術振興会先端バイオイメージング⽀援プラットフォーム(ABiS)、日本学術振興会 コホート・生体試料支援プラットフォーム、厚生労働科学研究費補助金「遺伝性脳小血管病の病態機序の解明と治療法の開発」、武田科学振興財団研究助成の支援を受けて行われました。
用語解説
※1脳小血管病:
脳の細い動脈によって、脳の循環は制御されています。内膜と中膜の2層構造で、間に内弾性板があります。大きさによって、軟膜血管、細動脈、毛細血管となり、細くなると内弾性板が消失します。この脳小血管を選択的に侵す疾患が脳小血管病です。ラクナ梗塞、白質病変などを呈します。
※2 Matrisome(マトリソーム):
私たちの体を構成している細胞の間は様々なタンパク質で構成される特殊な構造(細胞外マトリックス)で満たされています。細胞と細胞の間のクッションのようなイメージで、ここに他のタンパク質をためたり、組織の固さを調節したりしています。この細胞外マトリックスを構成する蛋白質の集団のことをマトリソームといいます。線維構造をとったタンパク質が主体で、ここに蓄積するタンパク質群を含めたタンパク質群の総称を指します。
※3 カンデサルタン:
正式名称: candesartan cilexetil。アンジオテンシン II タイプ1(AT1)受容体拮抗薬の一つで、降圧薬として用いられています。
※4 常染色体劣性遺伝形式:
2対ある遺伝子(対立遺伝子)の両方に同様の特性があるときに初めて現れる遺伝形式。疾患に関わる遺伝子であれば、両遺伝子に疾患に関連する変異があって初めて発症します。
※5 セリンプロテアーゼ:
タンパク質を分解する酵素であるプロテアーゼの中で、酵素の活性を担う構造の中心(活性中心)にアミノ酸の一種であるセリンを持つものを指します。
※6 ヘテロ接合体:
2対ある遺伝子(対立遺伝子)が同一ではない遺伝子を持つ個体のこと。疾患に関わる変異であれば、片側の遺伝子のみ疾患関連変異があり、もう片側が正常であることを指します。
※7 Gene-ontologyエンリッチメント解析:
遺伝子を生物的プロセス、構成要素および分子機能に着目して分類し、得られた遺伝子群において、特定の役割を果たす遺伝子群が多いか(エンリッチメントされているか)を統計学的に解析する手法。
※8 TGF-βシグナル:
トランスフォーミング増殖因子(Transforming Growth Factor-β:TGF-β)タンパク質によって惹起される細胞間の情報伝達。一連の遺伝子発現を誘導します。組織の修復などにおいて働きます。TGF-βはHTRA1の基質として知られます。
※9 RNAシーケンス:
次世代シーケンサーによって、サンプル内の、全てのRNAの配列と個数(コピー数)を解析するシーケンス法。トランスクリプトーム解析とも呼ばれます。





