脳アミロイドアンギオパチーの新たな病態を解明-ヒト乾燥硬膜移植後の脳内アミロイドとタウ蛋白の蓄積パターンを可視化-
2025年01月22日
概要
新潟大学脳研究所脳神経内科学分野の畠山祐樹医師、小野寺理教授、同研究所統合脳機能研究センターの木村篤史特任助教、島田斉教授らの研究グループは、ヒト乾燥硬膜(注1)移植後に発症した脳アミロイドアンギオパチー(CAA)(注2)患者さんの脳内アミロイドとタウ蛋白(注3)の蓄積パターンを、PET(注4)イメージングを用いて世界で初めて可視化しました。本研究により、ヒト乾燥硬膜移植後のCAAにおけるアミロイドとタウ蛋白の伝播メカニズムに新たな知見が得られました。
本研究成果のポイント
- ヒト乾燥硬膜移植後のCAA患者さんにおいて、アミロイドPETとタウPETを用いて脳内蛋白蓄積を可視化。
- アミロイドβ蛋白(注5)が血流または脳脊髄液を介して移植部位と反対側の大脳皮質に局所的に蓄積することを確認。
- タウ蛋白が移植部位と同側の大脳皮質に顕著に蓄積することを生体内で初めて観察。
- アミロイドとタウ蛋白の異なる蓄積パターンから、それぞれの伝播メカニズムの違いを示唆。
Ⅰ.研究の背景
CAAは、脳血管壁にアミロイドβ蛋白が蓄積する疾患です。これまでの研究から、アミロイドβ蛋白が移植されたヒト乾燥硬膜を介して伝播する可能性が指摘されていましたが、タウ蛋白(注4)については、ヒト乾燥硬膜移植後のCAAにおける生体内での蓄積パターンや伝播メカニズムがよくわかっていませんでした。
Ⅱ.研究の概要・成果
本研究では、幼少期にヒト乾燥硬膜移植を受け、成人になって以降に脳出血を発症したCAA患者さんを対象に、11C-PiBを用いたアミロイドPETと、Florzolotau(18F)(注6)を用いたタウPETにより脳内蛋白蓄積を詳しく調べました。
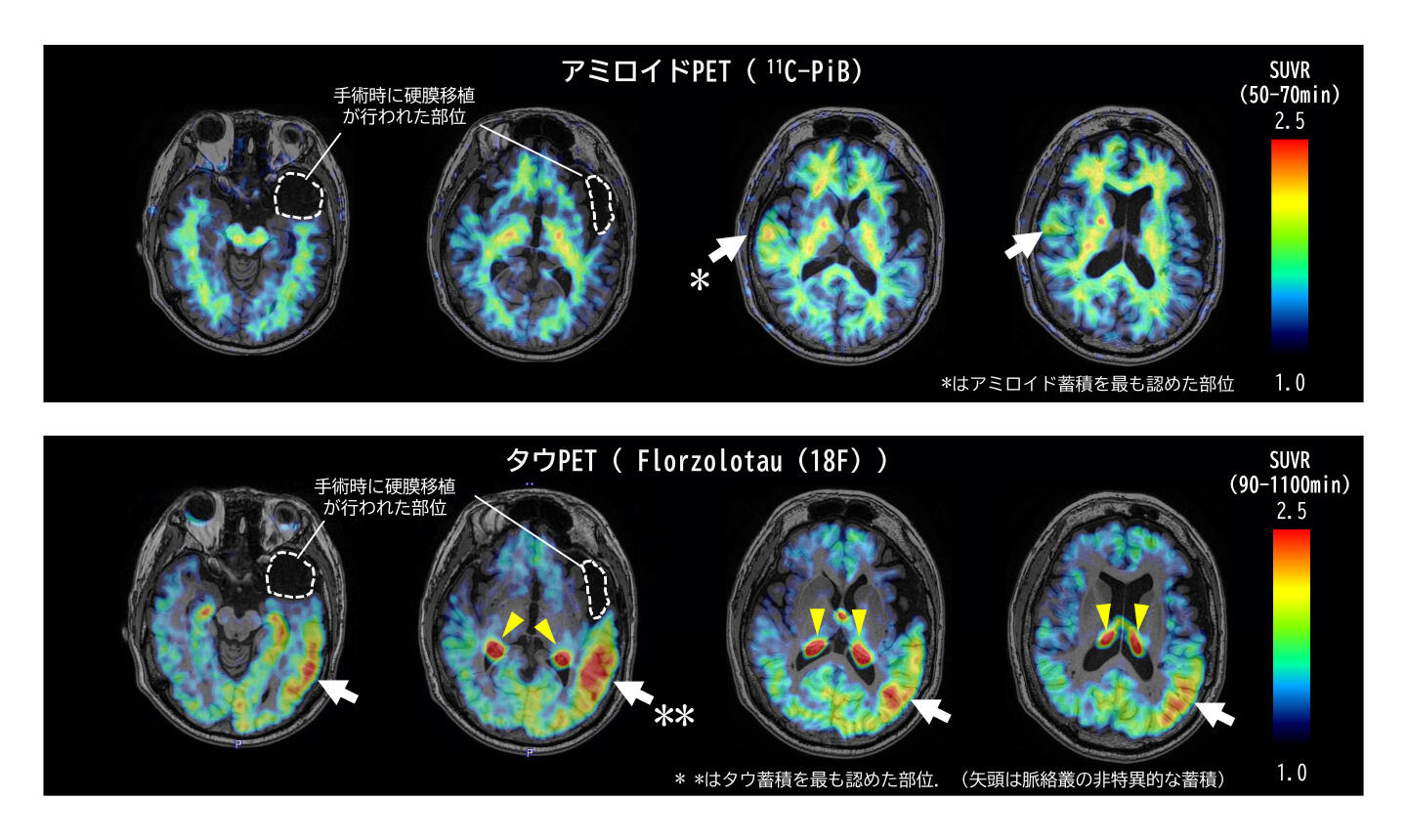
PET検査の結果、次のような新しい発見がありました:
1. アミロイドPETでは、ヒト乾燥硬膜移植部位と反対側の大脳皮質に局所的な集積が見られました。これは、これまでの報告と一致しており、アミロイドβ蛋白が血流や脳脊髄液を通じて広がる可能性を裏付けるものです。
2. タウPETでは、ヒト乾燥硬膜移植部位と同じ側の大脳皮質に強い集積が認められました。これは、実際に人の脳内でタウ蛋白の蓄積パターンを初めて示した画期的な発見です。
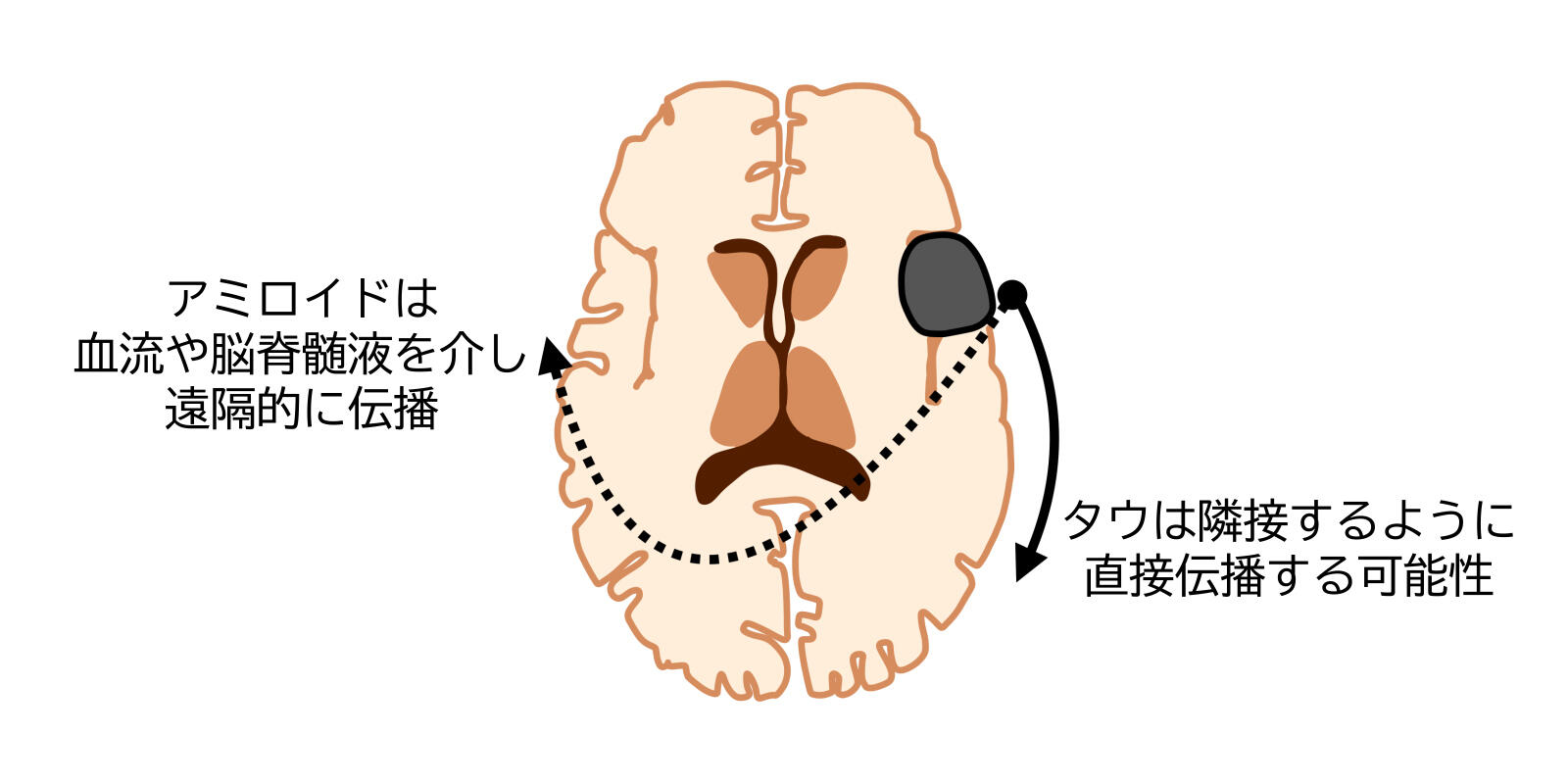
今回の研究は、タウ蛋白が移植したヒト乾燥硬膜から直接的に広がる可能性を示しています。特に、これまで生きている人の脳でヒト乾燥硬膜移植部位のタウ蛋白の広がりを捉えた報告はなく、本研究が初めてその可能性を示しました。
Ⅲ.今後の展開
本研究成果は、ヒト乾燥硬膜移植後のCAAにおけるアミロイドとタウ蛋白の伝播の仕組みの解明に大きく貢献しました。CAAだけではなくタウ蛋白が原因となるさまざまな神経変性疾患の病態を解明し、新しい治療法を開発する手がかりになる可能性があります。今後は、より多くの患者さんでの検討や長期的な経過観察を行うことで病気の仕組みをさらに解明し、効果的な治療法の開発につながることが期待されます。
Ⅴ.研究成果の公表
本研究成果は、2024年12月19日、分子イメージング領域のトップジャーナルである科学誌「European Journal of Nuclear Medicine and Molecular Imaging」に掲載されました。
| 論文タイトル | A case of cerebral amyloid angiopathy with ipsilateral tau and contralateral amyloid PET uptake related to cadaveric dura mater implanted in childhood |
| 著者 | Yuki Hatakeyama, Atsushi Michael Kimura, Shintaro Tsuboguchi, Mikhail Ratanov, Kosei Nakamura, Masahiro Hatakeyama, Yukimi Nakamura, Masaki Watanabe, Yoshihiro Murakami, Yuko Saito, Shigeo Murayama, Kensaku Kasuga, Takeshi Ikeuchi, Hironaka Igarashi, Osamu Onodera & Hitoshi Shimada |
| doi | 10.1007/s00259-024-07030-z |
▶ プレスリリース
Ⅵ.謝辞
本研究は、日本学術振興会科学研究費助成事業(科研費)基盤研究(B)(課題番号JP23H02825)および基盤研究(C)(課題番号JP18K07543)、科学技術振興機構(JST)創発的研究支援事業(FOREST)(課題番号JPMJFR220R)、YUJIN Memorial Award、Splink株式会社からの支援を受けて行われました。また、脳脊髄液RT-QuICおよび14-3-3蛋白測定にご協力いただいた長崎大学の佐藤克也教授、Florzolotau(18F)の放射性合成に使用されたトシル酸前駆体を提供いただいたAPRINOIA Therapeutics社に深謝いたします。
用語解説
- (注1)ヒト乾燥硬膜:薬事法に基づき輸入承認を得た医療用具であり、主として脳外科手術の際に切除した硬膜(脳と頭蓋骨の間にある、脳を保護する丈夫な膜)を補充するために使用されていました。病原体に汚染されていたものがあり、それが原因となって発症する病気があることが判明したため、1997年3月24日に使用が禁止されています。
- (注2)脳アミロイドアンギオパチー(CAA):脳の血管壁にアミロイドβ蛋白が異常に蓄積する病気です。これにより、脳出血や認知症などの症状が引き起こされることがあります。
- (注3)タウ蛋白:神経細胞の中で正常に存在する蛋白質ですが、異常に蓄積すると神経細胞の機能を障害し、認知症などの原因となることがあります。
- (注4)PET:Positron Emission Tomographyの略で、陽電子放射断層撮影法のことです。特殊な薬剤を体内に投与し、その分布を画像化することで、脳内の蛋白の蓄積などを調べることができます。
- (注5)アミロイドβ蛋白:脳内で正常に存在する蛋白質ですが、異常に蓄積すると神経細胞に悪影響を与え、アルツハイマー病などの原因となることがあります。
- (注6)Florzolotau(18F):国立研究開発法人量子科学技術研究開発機構で開発され、新潟大学脳研究所に技術移転をされた日本発のタウPET薬剤です(別名、18F-PM-PBB3)。2024年12月時点で、ヒトの多様な認知症や疾患モデル動物のタウ蓄積を高精度で可能な世界で唯一の検査薬です。





