脳動静脈奇形の発症プロセスを再現 -異常な脳血管構造の形成機序解明と治療法の確立へ-
2024年11月25日
概要
新潟大学脳研究所脳神経外科学分野の齋藤祥二医師(大学院生)、脳神経疾患先端治療研究部門の棗田学特任准教授、システム脳病態学分野の中村由香特任助手、田井中一貴教授、上野将紀教授らの研究グループは、慶應義塾大学、ハンブルク・エッペンドルフ大学医療センターとの共同研究により、脳動静脈奇形を発症するモデルマウスを開発し、異常な血管構造が作られる病態の形成機序とそれを抑止する方法論を明らかにしました。
本研究成果のポイント
- 脳動静脈奇形を発症するモデルマウスを開発した
- 脳動静脈奇形の病態の形成機序を見出した
- 脳動静脈奇形の形成を抑える方法を見出した
Ⅰ.研究の背景
脳動静脈奇形(brain arteriovenous malformation: bAVM)は、脳の中で異常な血管形成をきたす疾患です。動脈と静脈が毛細血管を介さず直接つながり、もつれた血管がナイダスと呼ばれる特徴的な血管塊を形成します。ナイダスでは、動脈と静脈が直接吻合するため、ナイダスや静脈内の圧が上昇し、血管壁が薄くなっていきます。そのため、血管の破裂が起こりやすくなり、出血のリスクが高まる重篤な脳疾患です。主に若齢で発症し(10万人あたり約10人)、脳卒中の1~2%、小児・若年における脳出血の3分の1を占める要因となっています。治療法には、外科的切除、血管内塞栓術、定位放射線治療がありますが、ナイダスが大きい場合や重要な機能を持つ脳領域にある場合には、侵襲的な治療法によって、機能予後を悪化させるリスクが高くなります。
これらの課題に対しては、非侵襲的な治療法の開発が、大きく貢献する可能性があります。これらの治療法を開発するには、脳動静脈奇形が発症する機序を土台に、治療の標的を見出す必要があります。しかし、脳動静脈奇形は、通常、胎生期や小児期に脳内に形成され、また出血やてんかんといった異変によって、はじめて病変が見出されるケースがほとんどのため、異常な血管構造が形成される過程は、ほとんど理解が進んでいないのが現状です。
近年、脳動静脈奇形の血管内皮細胞において、がん遺伝子として知られるKRASの遺伝子変異が見出されました(Nikolaev et al., N Eng J Med 2018)。KRASは、チロシンキナーゼ受容体の下流で働くRAS GTPaseですが、特に12番目のコドンに変異が起こると、恒常的に活性化し、異常な細胞の成長や増殖を引き起こすことが知られています。しかし、脳動静脈奇形において、このKRAS変異が、出生の前後に異常な血管構造を形成するプロセスは不明のままでした。
Ⅱ.研究の概要・成果
今回、本研究グループは、脳動静脈奇形の形成機序や治療標的を見出すため、出生後に脳動静脈奇形を発症するマウスモデルを確立することを目指しました。まず、脳の血管内皮細胞を標的に感染するアデノ随伴ウイルス(AAV)と血管内皮細胞特異的にCre組換え酵素を発現する遺伝子組換えマウス(Cdh5-CreERT2マウス)を組み合わせることにより、脳の血管内皮細胞にのみKRASの変異遺伝子を発現させることに成功しました。脳の肉眼、組織学的な観察から、この変異KRASは、脳の中で、異常な血管構造のもつれや局所的な出血を引き起こすことがわかりました(図1A)。より詳細にこの血管構造を観察するため、青色のラテックスや赤色蛍光タンパク質で血管を標識し、透明化した脳組織を3次元的に解析しました。その結果、ヒトのナイダスと同様に、動脈と静脈が直接つながる血管網を形成し、さらには血管の拡張や動静脈瘤の形成を起こしていることが明らかになりました(図1B, C)。これらの血管では、KRASの下流で働くMAPK-ERKのシグナルが異常に活性化し、血管内皮細胞の増殖や細胞容積の増加が観察されました。また局所的な出血や炎症、周囲グリア細胞の活性化も認められました。これらの細胞群の病態形成への役割を探るため、single-cell RNA-seq(注1)により、各細胞種の動態を探りました(図1D)。その結果、血管内皮細胞において血管関連因子をはじめとする遺伝子の発現異常が起こり、周囲の血管壁細胞、ミクログリア、アストロサイト、炎症細胞においても、遺伝子発現と活性状態、各細胞種サブタイプの分布の挙動が大きく変化することを見出しました。最後に、治療の方法論を探索するため、特定の配列を持つmRNAを分解できるCRISPR/CasRx(注2)に着目しました。変異KRASのmRNAを標的とするCRISPR/CasRxを、AAVにより脳の血管内皮細胞に導入し、変異KRASの発現を直接抑制することを試みました(図1E)。その結果、この方法は、脳動静脈奇形の形成を効率的に抑制できることがわかりました。この作用は、MAPK-ERKシグナルを抑制する薬剤 trametinibよりも効果が高いことがわかりました。
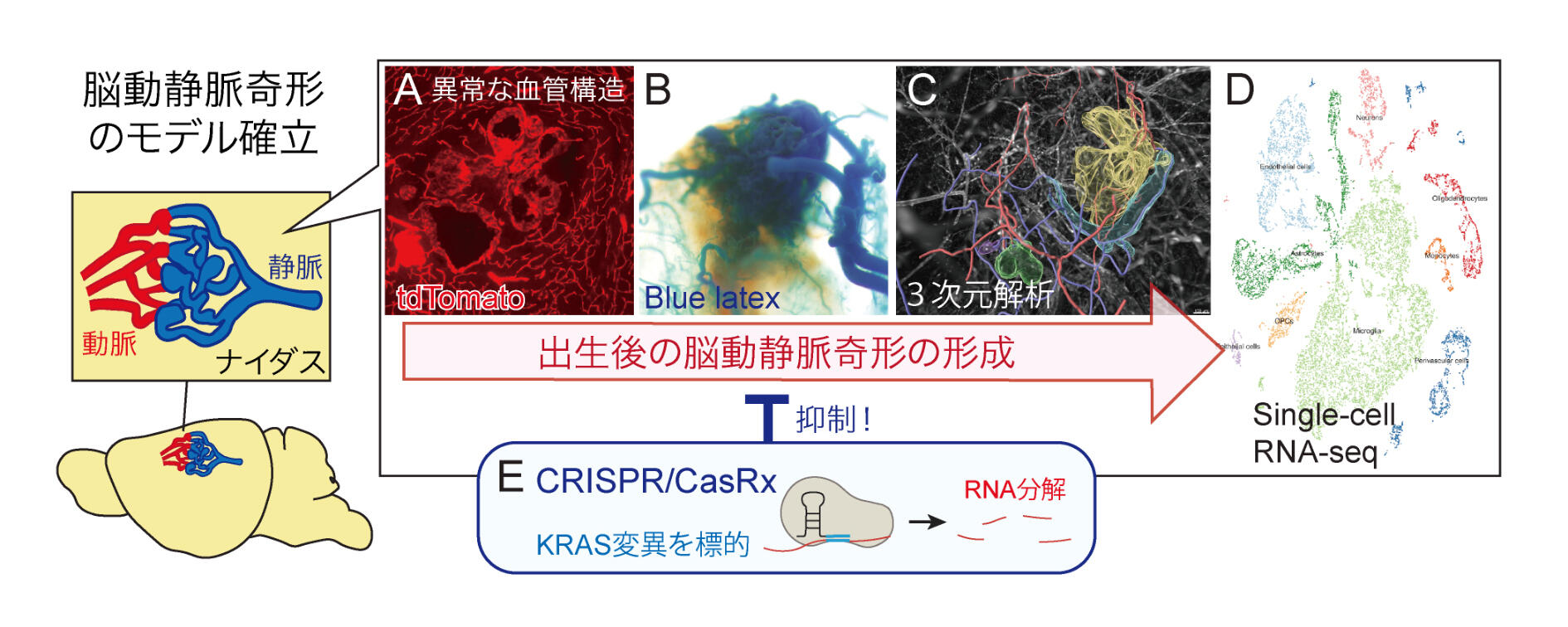
図1. 脳動静脈奇形のモデルマウスにおける病態の形成機序と抑止法
(A)赤色蛍光タンパク質で標識した異常血管の組織像。(B) 青色ラテックスの灌流で可視化した異常血管の形成。
(C) 脳の透明化による脳血管構造の解析。
(D) Single-cell RNA-seqによる各細胞種の動態。
(E) CRISPR/CasRxによる脳動静脈奇形の形成の抑止。
Saito et al., JCI Insight 2024を改訂。
Ⅲ.今後の展開
本研究で開発した脳動静脈奇形のモデルマウスは、出生後にはじまる病態形成のプロセスを、血管構造、細胞種、遺伝子発現のレベルではじめて明らかにし、CRISPR/CasRxによる治療戦略の有用性をはじめて示しました。このモデルは、新生児期からはじまる異常血管の形成プロセスを模倣するはじめての実験モデルであり、本疾患の研究に有用なプラットフォームを提供するものです。今後、脳動静脈奇形のさらなる形成機序の解明や治療法の開発に寄与することが期待されます。
Ⅳ.研究成果の公表
本研究成果は、2024年11月22日(米国東部標準時間)、JCI Insight誌に掲載されました。
| 論文タイトル | CRISPR/CasRx suppresses KRAS-induced brain arteriovenous malformation developed in postnatal brain endothelial cells in mice |
| 著者 | Shoji Saito, Yuka Nakamura, Satoshi Miyashita, Tokiharu Sato, Kana Hoshina, Masayasu Okada, Hitoshi Hasegawa, Makoto Oishi, Yukihiko Fujii, Jakob Körbelin, Yoshiaki Kubota, Kazuki Tainaka, Manabu Natsumeda, Masaki Ueno |
| doi | 10.1172/jci.insight.179729 |
Ⅴ.謝辞
本研究は、科研費 (20K17921、21H02590)、AMED-CREST (JP21gm1210005)、先端ゲノム支援(16H06279、JP22H04925)、協和会医学研究助成金などの支援を受けて行われました。
用語解説
- (注1)Single-cell RNA-seq:1細胞のレベルで遺伝子の発現を網羅的に解析できる技術であり、遺伝子発現の変動や各細胞種の動態の変化を解析することができる。
- (注2)CRISPR/CasRx:細菌や古細菌において、外来性のウイルスやプラスミドの遺伝情報をもとに排除するCRISPR/Casシステムのうち、ルミノコッカス属の菌がもつ、特定の配列を持ったmRNAを分解するシステムを由来とし、哺乳類の細胞においてmRNAの発現を抑えるよう改良されたもの。





