脳梗塞に対する、ヒト末梢血単核球を用いた新しい細胞療法の開発
2023年06月20日
概要
新潟大学脳研究所脳神経内科学分野の大津裕(助教)、畠山公大(助教)、金澤雅人(准教授)らの研究グループは、岐阜大学大学院医学系研究科脳神経内科学分野の下畑享良(教授)、神戸医療産業都市推進機構医療イノベーション推進センターの尾前薫(TRI専門職)、LHS研究所の福島雅典(代表理事)と共同研究を行い、脳梗塞に対するヒト末梢血単核球を用いた新しい細胞療法の作用機序を明らかにしました。末梢血液中には、単核球という細胞が存在し、脳梗塞後の病態に関与します。本研究では、ヒト由来の単核球に薬剤を用いない簡単な刺激を行い脳梗塞ラットに投与することで、脳梗塞後遺症が大幅に改善することを明らかにし、またその作用機序を解明しました。本発見は、脳梗塞の画期的な治療法の開発につながるものと期待されます。
研究成果のポイント
・酸素とブドウ糖の濃度を短時間低下させるという簡単な刺激(低酸素・低糖刺激)により、ヒト単核球が組織を修復する能力を活性化することを明らかにした。
・通常の単核球投与では、治療効果は認めないが、投与前に細胞を低酸素・低糖刺激すると脳組織保護的に性質が変わることを明らかにした。
・投与細胞の脳内作用機序として、投与した単核球と脳内の細胞との細胞間情報伝達に、エクソソーム中のマイクロRNA-155-5pが重要であることを示した。
・細胞療法の作用機序を明確にし、細胞間情報伝達の重要性を示した。
Ⅰ.研究の背景
脳卒中は、日本における死因の第4位、寝たきりの原因の第2位となっています。高齢化社会を迎え、脳卒中患者さんは急増し、3人に1人が脳卒中を発症する時代に突入しました。脳卒中のなかでも、血管が詰まることで発症する脳梗塞は、近年増加し、後遺症に苦しむ患者さんも多く、治療にかかる医療費は増加の一途をたどっています(日本では年間2兆円)。
脳梗塞慢性期の治療は再発の予防が主体で、機能回復療法はリハビリに限られます。しかし、リハビリでも十分な機能回復を得られず、後遺症をもつ患者さんが多くいます。
Ⅱ.研究の概要・成果
脳梗塞後の脳の障害のメカニズムは非常に複雑で、さまざまな物質が関わるため、単一の物質を標的とする治療では十分な効果を期待することは難しいです。また脳には血液脳関門という血管内の物質を脳に入りにくくするバリアがあり、薬剤が到達しにくいという問題があります。そこで現在、細胞投与により脳梗塞を治療する手法(細胞療法)の研究が盛んに行われています。
これまで、本研究グループは血液中に存在する単核球に着目して研究を行ってきました。通常の単核球投与では治療効果は認めません。一方、本研究グループは、ラットの単核球を脳梗塞に類似した環境(すなわち酸素とブドウ糖の濃度が低下した状態)に短時間曝露させる、という簡単な刺激により、単核球が持つ組織を修復する能力が活性化することを示しました。また、刺激した単核球を脳梗塞ラットに投与することにより、脳梗塞後遺症が改善することを示してきました。これは、採血のみで細胞を採取できるため、患者さんへの負担が少ない点、特殊な細胞培養施設を必要としない点で、従来の細胞療法(iPS細胞や培養した幹細胞など)に比し、格段に簡便かつ低コスト化した細胞療法の開発につながる知見であると考えます。
しかし、ヒト由来の単核球にも同様の治療効果があるのか、また効果があるとすればそれはどのような作用機序によるものか、明らかではありませんでした。
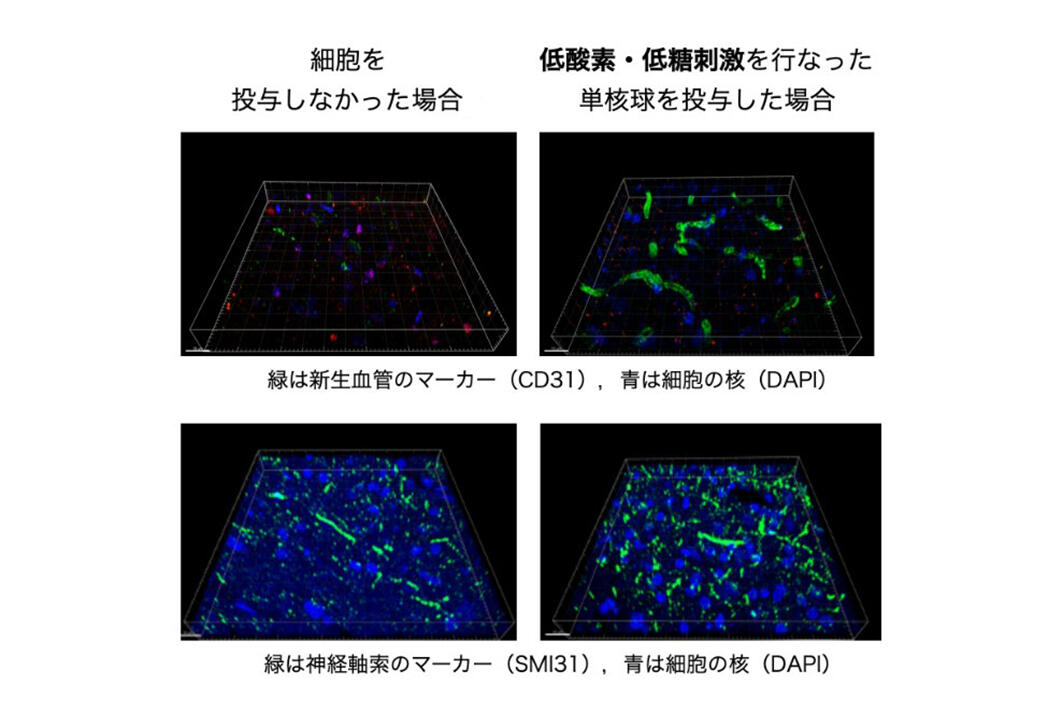
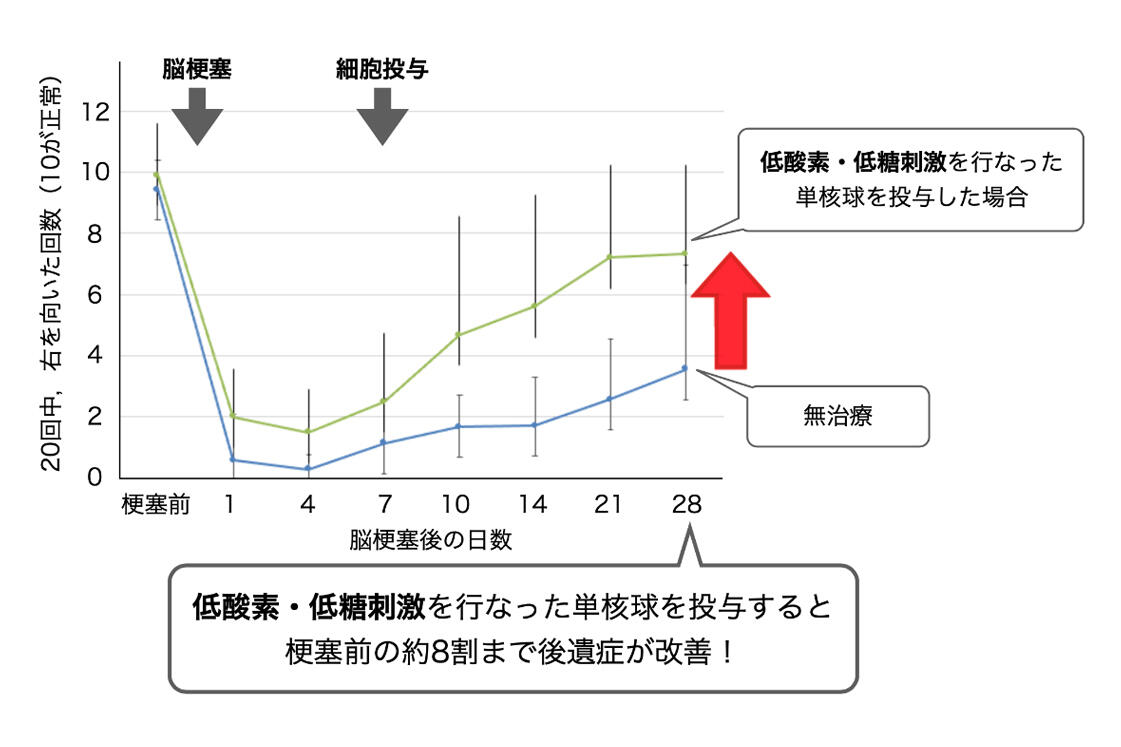
そこで本研究グループはヒト単核球に低酸素・低糖刺激を与え、脳梗塞発症後1週間が経過したラットに細胞を投与しました。その結果、細胞がバリアを超えて脳内に入り込み、脳梗塞病変における新しい血管の再生、および神経軸索の再生が促進され(図1)、脳梗塞後遺症である運動感覚障害の回復が促進されることを(図2)明らかにしました。また作用機序として、投与した単核球が脳内に存在するミクログリアという細胞に情報を伝達することにより、脳内が組織保護的な環境に変化することを明らかにしました。
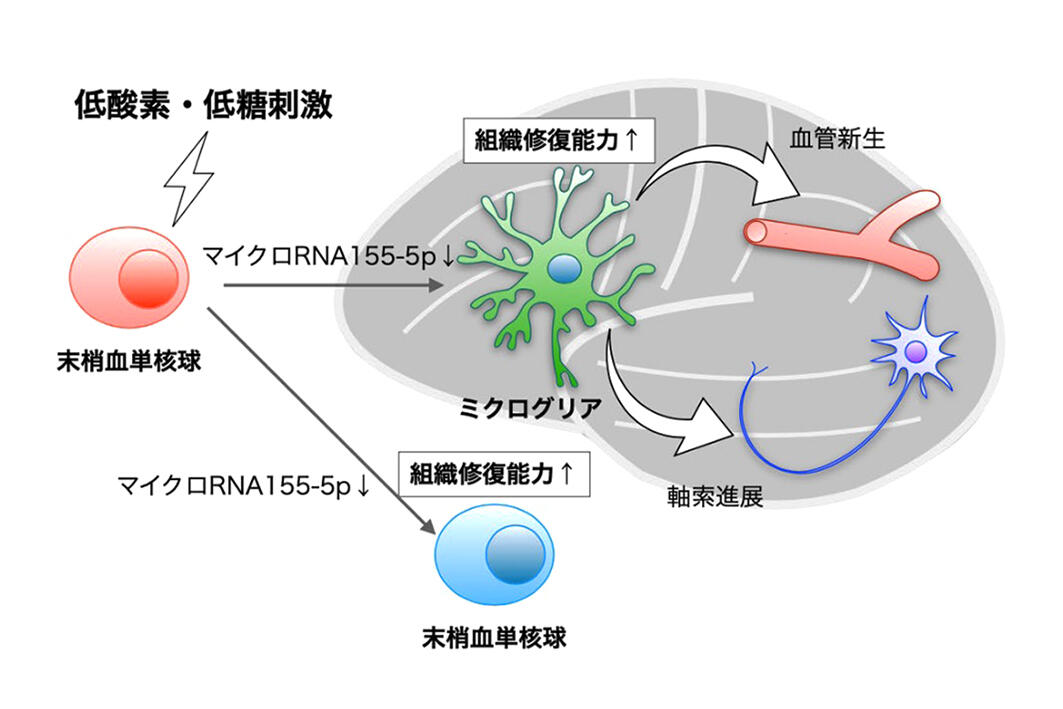
具体的には、細胞間の情報伝達に、細胞から分泌される直径50-150 nmの顆粒状物質エクソソームが関与し、エクソソーム中のマイクロRNA-155-5pを低下させることが脳内環境を変化させることを明らかにしました(図3)。
血管新生、神経再生に関わる血管内皮増殖因子(VEGF)は、脳梗塞後産生されますが、速やかに抑制される機構があります。マイクロRNA-155-5pが低下することで、低酸素誘導因子であるHIF-1αやその下流に位置するVEGF増加が維持されます。さらにその結果として、単核球やミクログリアの脳組織を修復する能力が活性化され、脳内で血管新生が促され、神経再生が生じ、治療効果を発揮することを明らかにしました。
ヒト単核球に簡単な刺激を行うことにより、単核球が組織を修復する能力を活性化することを明らかにしました。また、この細胞を脳梗塞後遺症のみられる患者さんに投与することで、機能回復が促進される治療法となりうることを示しました。
機能回復の機序として、投与した単核球が脳内のミクログリアに情報を伝達し、脳内の環境を変化させることを示しました。
細胞療法は効果的な治療であるものも、その作用機序が明確化されていないものが多いです。今回、その作用機序として、末梢血単核球同士、さらに投与した末梢血単核球から脳内ミクログリアに情報を伝達するものとして、エクソソーム中のマイクロRNA-155-5pが関与することを明らかにしました。
Ⅲ.今後の展開
この治療が実用化されれば、患者さん自身の細胞を用いた「自家細胞療法(注)」が可能になり、安全性の高いオーダーメイド医療となります。簡単な操作で細胞を製造できるため、特別な細胞培養施設をもたない一般病院においても治療を普及できる可能性があります。
現在、採血から細胞の分離、低酸素・低糖刺激までを一貫して行える装置を、産学共同で開発中です。本技術は、米国(US20190216856A1)、欧州(#3508207)、中国(ZL201780067469.9)の特許取得、国際特許出願(出願番号:PCT/JP2022/013766)を行い、臨床応用することを目指して研究を進めています。
Ⅳ.研究成果の公表
本研究成果は、2023年6月19日(米国東部時間)、米国実験的神経治療学会学会誌「Neurotherapeutics」(IF 6.088 5-yearIF 8.296)に掲載されました。
| 【論文タイトル】 |
Oxygen-Glucose Deprived Peripheral Blood Mononuclear Cells Protect Against Ischemic Stroke |
| 【著者】 | Yutaka Otsu, Masahiro Hatakeyama, Takeshi Kanayama, Natsuki Akiyama, Itaru Ninomiya, Kaoru Omae, Taisuke Kato, Osamu Onodera, Masanori Fukushima, Takayoshi Shimohata, Masato Kanazawa. |
| 【doi】 | 10.1007/s13311-023-01398-w |
Ⅴ.謝辞
本研究は、科研費(基盤(B)22H03183、基盤(C)18K07493、20K16485)、萌芽研究(21K19441)、日本医薬研究開発機構(JP19lm0203023)、武田科学振興財団、先進医薬振興財団、ブレインサイエンス振興財団森山賞、椿神経疾患研究基金などの支援を受けて行われました。
用語解説
(注)自家細胞療法: 患者自身の細胞を採取し、加工・増殖して患者へ戻す細胞療法。