2025年12月18日公開
担当:吉田 恒太 先生
所属:システム脳病態学分野(進化脳病態)
はじめに
私たちは病気になったとき、「何が悪かったのか」と、生活習慣や事故などの環境的な原因に思いをめぐらせることでしょう。また、病気になりやすさは人によって違うことから、遺伝的な原因について考えるかもしれません。しかしながら、病気の原因をつきつめていくと、最終的には「進化」という視点に行き着きます。なぜなら、私たちヒトがもつ身体や心の仕組みは、生物の約38億年にわたる進化の歴史の中で形成されてきたものだからです。
個々の病気には遺伝的または環境的な発症メカニズムが存在しますが、そのメカニズムの基盤そのものは進化の産物なのです。したがって、「なぜ病気になるのか」という問いへの究極的な答えは進化の研究によって与えられることでしょう。このコラムではまず「進化」とは何かを整理し、進化がどのようなプロセスによって起こるのかを説明します。その上で、病気への脆弱性が生み出される進化的メカニズムの可能性を示し、さらに、それらを科学的データに基づいて検証していく研究の方向性について話していきたいと思います。
進化とは何か
一般には「進化」という言葉は、物事が発展していくさまを指しますが、生物学における「進化」の定義はより厳密で、「生物集団における遺伝的特徴が世代をこえて変化していくこと」をいいます。
まず、進化の主体となるのは生物個体のグループ、すなわち「集団」です。たとえば「人類の進化」というとき、個々のヒトの変化ではなく、人類集団全体の変化を指しています。次に、重要なのは、進化は、親から子へ、子から孫へと世代を経ることで初めて観察される現象で、生物の個体が一生の中で形を変えることは進化とは呼びません。さらに、進化の対象となる特徴は「遺伝的」でなければなりません。遺伝情報の変化により特徴が変わっていくことが重要であり、栄養状態など環境によって一時的に変化するものは可塑的な変化として区別されます。
進化は、化石記録や現存する生物の比較解析、あるいは世代時間が短い生物を使った進化実験から、その存在が証明されてきた生物の本質的性質です。ダーウィンが「種の起源」1を出版して以来、世界中の研究者によって、進化の歴史とメカニズムが明らかにされてきました。現在では、全ての生物はルカ(LUCA)という一つの共通の祖先をもつことが知られています2。あらゆる生物はルカから進化する過程で、他の生物たちと分かれて、最終的に一つの種として現存しています。例えば、ヒトが進化するまでには、真核生物の進化、動物の進化、脊椎動物の進化、四足動物の進化、哺乳類の進化、霊長類の進化、類人猿の進化を経て、現在にいたります(図1)。このような他の生物との枝分かれを示した図を系統樹といいます。生物多様性は、系統樹にみられるように多くの種が分かれるとともに独自の特徴を進化させてきた結果生まれてきたものです。それでは、このような進化はどのように生じるのでしょうか。
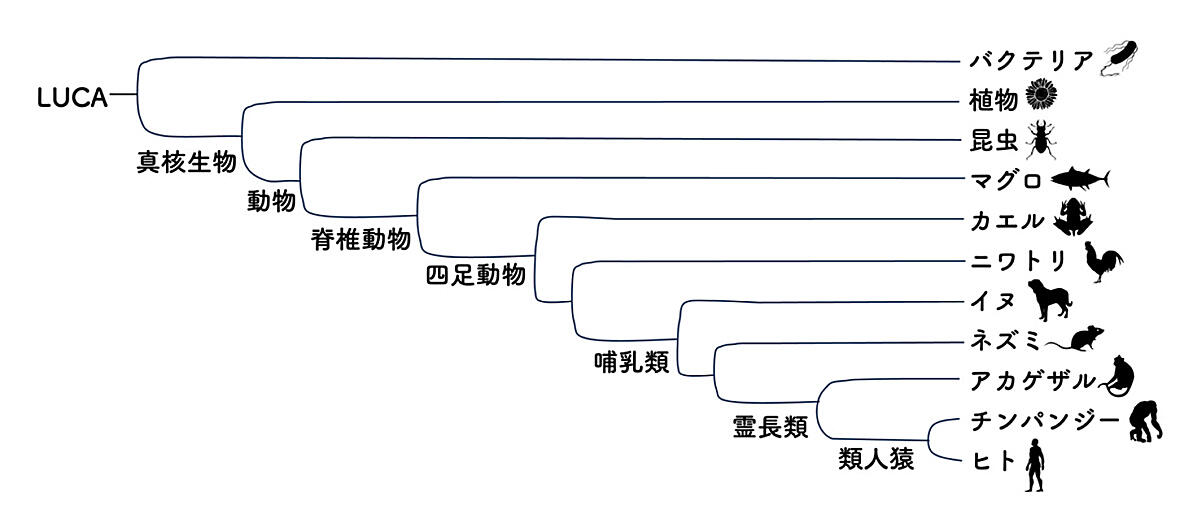
図1. ヒトといくつかの生物種との間の進化的関係性を示した系統樹
全ての生物の共通祖先であるLUCAからはじまり、左から右に種が分岐する歴史的経過を示しています。分岐の順序は示してあるが、実際の時間的長さは反映していません。進化のプロセス
進化の源泉は「突然変異(mutation)」です。突然変異は私たちの遺伝情報がゲノムDNAという化学物質に記録されているために生じる宿命です。このゲノムDNAに酸化ストレスによる損傷、細胞分裂のためのコピー時のエラー、あるいは、ウイルスのような寄生性DNAの侵入などにより、偶発的な書き換えがおこると遺伝子の新しいタイプ(アレル)があらわれます。これが突然変異です。このような突然変異は私たちの生殖細胞では一定の頻度で必ず発生することが確認されています3。したがって、親と子の間で遺伝情報がわずかに変わることは普通のことなのです。こうして生じた新しい遺伝子のタイプが、親から子へ、子から孫へと代々引き継がれていくと、遺伝的なヴァリエーションとして集団に存在し、集団の中で増えたり減ったりします。それが最終的に集団全体に完全に行き渡ることを「固定」といい、このとき「遺伝子の新しいタイプが進化した」とみなされます(図2)。すなわち、進化とは、① 突然変異の出現と②その集団内の固定という大きな二段階からなります。この遺伝子の新しいタイプの進化はDNAの配列が変わるだけで必ずしも表現型(目に見える特徴)の進化にはならないかもしれません。表現型が変わったとしても、顔の形が少し違うなどの微々たる違いにしかならないかもしれません。進化というのは、私たちの目に見えない分子のレベルで着実に進行している現象なのです。
このような突然変異が固定するプロセスについては大きく分けて二つの機構が考えられます。
1.自然淘汰
突然変異が生存に有利な特徴をもたらす場合、その突然変異は選択されて、集団に残りやすくなります。このような自然淘汰(自然選択)を「正の淘汰」といいます。逆に生存に不利な特徴をもたらす突然変異は選択的に排除されます。このような自然淘汰を「負の淘汰」といいます。生物の新しい機能的な特徴の進化は主に正の淘汰によって説明されますが、実際は負の淘汰が大きな役割を果たしています。遺伝子の情報というのは繊細にDNAに記録されていて、一つの分子の書き換えだけで遺伝子が完全に機能しなくなってしまうことがよくあります。機能的な遺伝子に入った突然変異の多くは有害突然変異として、生存率をさげることになり、負の淘汰により排除されることになります。実際、遠く離れた生物種でも共通するDNA配列が残っているのは、度重なる有害突然変異の出現にもかかわらず、負の淘汰によりそれらが排除されてきた結果なのです。
2.遺伝的浮動
次に考えられる可能性は遺伝的浮動です。生存に有利でも不利でもない「中立的な突然変異」は確率的に集団の中で増減します。この確率的な増減のことを遺伝的浮動といいます。長い時間が経過すると、多くの中立的突然変異は失われますが、一部は偶然、集団に固定します。20世紀の前半までは、この機構はそこまで重要視されていませんでした。実際にゲノムDNAの配列が調べられ始めたことで、この機構による影響が無視できないものであることがわかってきたのです4。ゲノムDNAの中に毎世代生じる多くの突然変異は中立的なものだと考えられています5。最終的にその中のわずか一部が固定したとしても、数としては大量になります。
この遺伝的浮動は集団のサイズに大きく左右されます。例えば、無人島に二人しかいないような小集団ではすぐに遺伝的浮動による固定が起こりますが、もし集団が無限大に近いとすると、いつまでたっても遺伝的浮動による固定はおこりません。このように集団のサイズが小さいと遺伝的浮動の影響で偶然的な固定が起こりやすくなり、集団のサイズが大きいと偶然的要素が弱くなり、自然淘汰の影響が強くなります。このバランスは、後に病気の起源を考える上で重要になります。
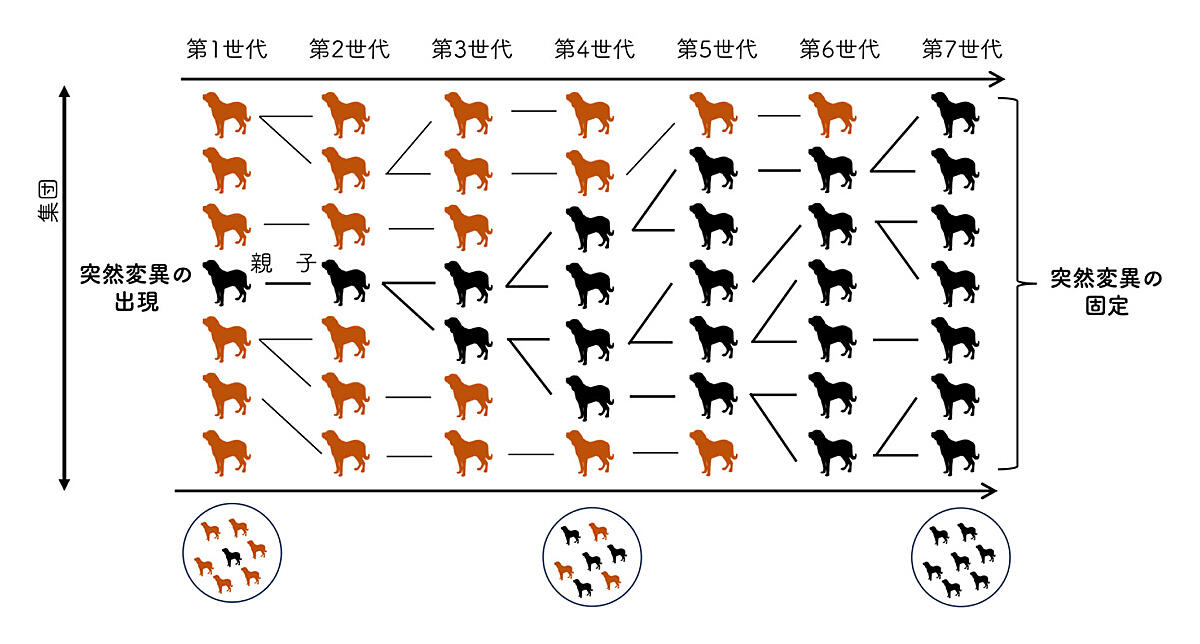
図2.集団に現れた突然変異が固定するプロセスの模式図
第一世代に生じた突然変異が六世代を通して集団に固定するさまを示しています。単純化のため、七個体の集団を想定しており、縦に並んだ個体がその状態を反映しています。個体間の線は親子関係。集団遺伝学では図のように集団サイズを一定として基礎的なモデルを構築します。この際、一個体の次世代に残せる子供の数は確率的に決まると考えます。本来、動物の普通の染色体は二倍体なので、オスとメスとの交雑と遺伝子の組み換えにより遺伝子のタイプが決まりますが、一個体の親から子が生まれる一倍体として単純化しています。病気への脆弱性はどのように進化し得るか
以上の枠組みを踏まえ、なぜ病気に対する脆弱性が進化し得るのかを議論します。ここでは病気を作り出す遺伝的因子全体について話す上で、病気のリスク因子に似たものを考えます。集団中にその突然変異が固定していないのであれば、それはリスク因子といえますが、固定してしまうと、その特徴はもはやその集団(あるいは種)の一般的な病気のメカニズムの基盤となるからです。一方で、家族性遺伝病の原因因子のように病気に直結する突然変異は、集団に固定していないからこそ遺伝病であるので本稿では扱いませんが、その広がり方については類似の議論が可能だと思います。この突然変異が集団に固定するプロセスには、少なくとも次の三つが考えられます(図3)。
1.正の淘汰を受けた結果の代償
ある突然変異が人類にとって明らかに有利であり、正の淘汰によって固定した場合、その有利性が病気への脆弱性を上回っていた可能性がありえます。このようにして、正の淘汰によって、病気の脆弱性が進化した可能性が考えられます。例えば人類特有の大きな脳や高度な言語機能、二足歩行などは、生存に有利であったと想像されますが、それが一方で病気の脆弱性の原因となった可能性があります。ヒトの脳は拡大化したことで、大量の血流による糖と酸素の供給が必要になりました。さらに、二足歩行によって脳が心臓より高い位置にあるため、さらに血圧をあげなければいけなくなったと考えられます。これが人類における高血圧、脳卒中、動脈瘤への脆弱性を引きあげたと考えられています6。
また、ある時代には強力な正の淘汰が働いていたが、現代ではその自然淘汰の原因は消失し、代償となる脆弱性だけが残っている可能性もあります。例えば、免疫関連遺伝子のタイプは、過去の感染症に対抗できたために正の淘汰により広がる一方で、その副作用で病気への脆弱性をあげた可能性があります。以下は固定したケースではないですが、マラリア抵抗性をもつ鎌状赤血球HBBアレルはヘテロ接合ではマラリア抵抗性がありますが、ホモ接合になると鎌状赤血球症になり、重篤な血液疾患になってしまいます7。また、APOL1変異は寄生虫であるトリパノソーマへの抵抗性をもたらしますが、慢性腎臓病などのリスクを高めてしまいます8。このような代償は現在、遺伝子が固定していないからこそ見つかっていますが、このようなものが固定してしまった場合は人類に一貫して見られる病気の脆弱性となりえるでしょう。
2.中立的な突然変異による脆弱性
遺伝子は繁殖によって次世代に伝わるので、最終的に繁殖にかかわらない特徴は進化的に中立的になります。したがって、繁殖年齢を過ぎた後の生存率に関わるような加齢性疾患は、自然淘汰の影響を受けず、中立的に進化する可能性があります。また、病気への脆弱性そのものが最近になって生じたものであり、その要素は中立的に進化してきた可能性もあります。実際に、現代人の病気の一部は、これまで人類の進化の歴史では経験しなかった環境要因(新しい食生活、ストレス、寿命延長、都市環境など)によって引き起こされるため、それらの病気への脆弱性の進化を自然淘汰で説明することは難しいかもしれません。
3.集団サイズの変動による弱有害突然変異の蓄積
集団のサイズが小さくなると、自然淘汰の効果が弱まり、遺伝的浮動の効果が強くなります。有害突然変異の中でも、その有害性が小さい弱有害突然変異であれば、本来大きな集団では負の淘汰によって取り除かれるはずでも、小さな集団では遺伝的浮動の効果で固定してしまう可能性があります。すなわち、集団が小さければ、小さな病気の脆弱性は固定しまうということです。人類史では、集団が小規模になった時期が繰り返し存在しました9。特に、人類が新天地を求めて移動した時、それはとても小さな集団からはじまり、大きな集団に広がったと考えられます。そうすると、その小さな集団であった時期に弱有害突然変異が固定し、現代人に脆弱性として残った可能性があります。
さらに、ここで考えている遺伝的浮動に関わる集団のサイズというのは実際の個体数ではなく、遺伝子それぞれで違う集団サイズを考えることもあります。遺伝子に正の淘汰や負の淘汰がかかると周りの遺伝子も含めて、集団から次の世代に残る遺伝子のタイプ(アレル)が減ります。あくまで個体数は変わらないので、減った分が他のタイプで補われているわけですが、この時、その遺伝子周辺では小集団から次世代ができるのと同じことが起こります。このようにして、集団サイズが大きければ、自然淘汰が働きますが、自然淘汰が働く結果として、集団サイズが逆に減ってしまうことがあります。すると、これを原因として弱有害突然変異が蓄積し、病気の脆弱性が増える可能性があります。弱有害突然変異は一つだけでは問題にならないかもしれませんが、固定してしまうと、もはや集団から除けなくなるので、弱有害突然変異の蓄積が積み重なることで、大きな脆弱性につながる可能性があります。
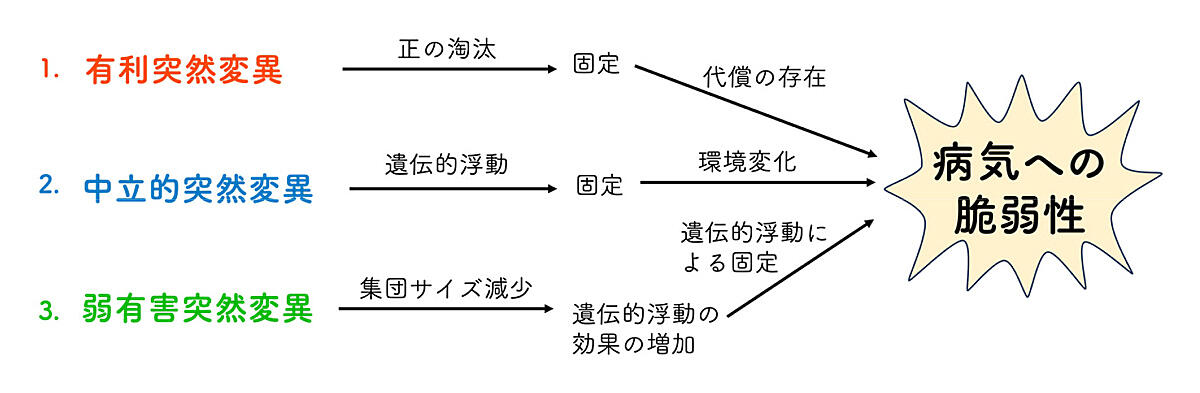
図3.病気への脆弱性が進化する三種類のプロセス
異なる種類の突然変異がどのようにして病気への脆弱性につながりうるかを示しています。どのように病気の起源を研究するか
以上のように病気の脆弱性は複数の進化的プロセスを通じて形成されえます。そのプロセスの違いにかかわる突然変異の起こりやすさ、過去の自然淘汰、遺伝的浮動、集団サイズの変動などはゲノムDNAの情報を使い、統計学的手法やシミュレーション解析を用いて、痕跡をみつけることがある程度可能です。具体的的な方法の一つとして、ヒトと他の生物種とのゲノムDNAの比較により、他の生物での突然変異の発生率や保存生から、ヒトで生じた突然変異の特殊性を調べることができます。もう一つの方法として、ヒト集団内あるいは集団間での比較により、その突然変異がどのような歴史を持って広がり、固定したのかを推定できます。このような解析により、突然変異の進化的背景を知ることで、病気の脆弱性が生み出された起源を知ることができます。また、病気の進化的起源と関係するような遺伝子を調べ尽くすことで、病気の発生機序の理解にも貢献する知見が得られることが期待できます。
私はこのような手法を駆使して「進化脳病態学」を確立しようと昨年、新潟大学脳研究所に進化脳病態学研究室をたちあげました。まだ、研究は道半ばですが、将来的に皆様に脳の病気の起源にせまる研究結果を報告できるように研究を進めているところです。
参考文献
- Darwin, C. (1859). On the origin of species (John Murray).
- Moody, E.R., Álvarez-Carretero, S., Mahendrarajah, T.A., Clark, J.W., Betts, H.C., Dombrowski, N., Szánthó, L.L., Boyle, R.A., Daines, S., and Chen, X. (2024). The nature of the last universal common ancestor and its impact on the early Earth system. Nature Ecology & Evolution 8, 1654-1666.
- Nachman, M.W., and Crowell, S.L. (2000). Estimate of the mutation rate per nucleotide in humans. Genetics 156, 297-304.
- Kimura, M. (1979). The neutral theory of molecular evolution. Scientific American 241, 98-129.
- Nei, M., Suzuki, Y., and Nozawa, M. (2010). The neutral theory of molecular evolution in the genomic era. Annual review of genomics and human genetics 11, 265-289.
- O'Rourke, M., Stone, J., Adji, A., Kim, M.O., Li, Y., Wang, J.G., Avolio, A., Eide, P.K., and Czosnyka, M. (2020). The human systemic and cerebral circulations: contrasts in structure and function. Artery Research 26, 197-211.
- Esoh, K., and Wonkam, A. (2021). Evolutionary history of sickle-cell mutation: implications for global genetic medicine. Human molecular genetics 30, R119-R128.
- Cooper, A., Ilboudo, H., Alibu, V.P., Ravel, S., Enyaru, J., Weir, W., Noyes, H., Capewell, P., Camara, M., and Milet, J. (2017). APOL1 renal risk variants have contrasting resistance and susceptibility associations with African trypanosomiasis. elife 6, e25461.
- Ramachandran, S., Deshpande, O., Roseman, C.C., Rosenberg, N.A., Feldman, M.W., and Cavalli-Sforza, L.L. (2005). Support from the relationship of genetic and geographic distance in human populations for a serial founder effect originating in Africa. Proceedings of the National Academy of Sciences 102, 15942-15947.





