2025年9月16日公開
担当:ドウニョン ゴッドフリッド 先生
所属:脳病態解析分野
人間の脳は日々さまざまな刺激や情報を処理しています。例えば、まぶしい照明が灯り、壁が乱雑な模様で覆われ、大きな騒音が響く部屋に入ったら、不快感や気が散る感覚、さらには不安を覚えるかもしれません。自閉スペクトラム症(ASD)を持つ人々にとって、これは単なる一時的な不快感ではなく、日常生活の一部となることがあります。自閉症の人々は、視覚、聴覚、触覚に対してより敏感であり、それが社会的関わりや集中、安心感を得ることを難しくします。近年の研究では、ASDは遺伝的要因と環境要因の両方に影響されることが示されています。しかし、この2つの要素がどのように相互作用しているのかについては、いまだ議論が続いています。本稿では、特定の環境がASDの困難さを悪化させる可能性について探り、周囲の環境を調整することで社会的交流を改善できるかを議論します。特に、神経科学研究における意外な協力者、ゼブラフィッシュに焦点を当てます。
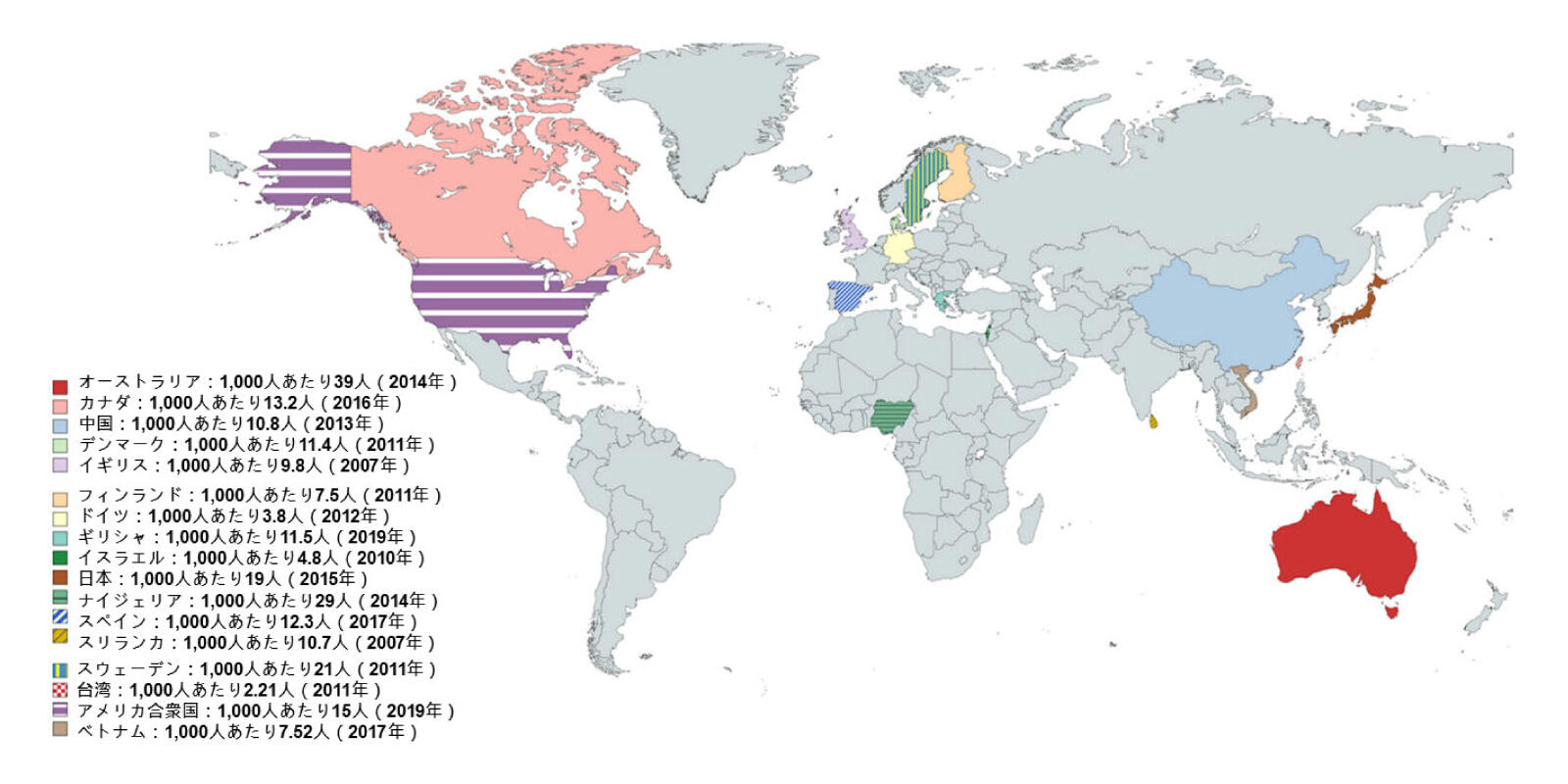
1.遺伝子だけではASDを説明できないかもしれない自閉症は、1943年にレオ・カナーによって初めて記載され1,2、幼少期発症および社会的・情動的関係の障がいを特徴とする特異な症候群として定義されました。しかし現在では、自閉症は「自閉スペクトラム症(ASD)」としてDSM-53やICD-104により広く認識されています。ASDは、コミュニケーション、社会的相互作用、行動に影響を与える神経発達症の一つです。ASDの人の割合は世界全体でおよそ1.5%と報告されており5,6、国によって差があります(図1)。
研究により、NF1、PTEN、SHANK3、CNTNAP2、FMR1、UBE3A など、多くのASD関連遺伝子が特定されています7-9。しかし、これらの発見がすべてを語るわけではありません。遺伝的素因を持ちながらも重度の症状を示さない人々が存在する一方で、外部要因によってより強く影響を受ける人々もいます10。つまり、遺伝子が舞台を整える一方で、環境といった他の要因が「演技」を形づくるのです。実験室という統制された環境において、ゼブラフィッシュはASD研究の効果的なモデルとなります。
2.小さな魚が人間の行動とASD理解に貢献する一見すると単純な生物に見えるゼブラフィッシュですが、神経科学や遺伝学研究において重要な役割を果たしています。ゼブラフィッシュは人間と多くの遺伝子を共有しており、特に神経発達や脳機能に関与する遺伝子が含まれます。その利点の一つは、飼育が容易で大量に増やせること(約200-300個の卵/週)、さらに遺伝子操作が可能であり人間の疾患モデルを作製できる点です6,11,12。ゼブラフィッシュの脳には、セロトニン、ドーパミン、グルタミン酸といった人間の感情や学習、記憶を制御する神経伝達物質が含まれています。脳の構造自体は単純ですが、神経回路の基本構造は保存されており13、感覚認知、不安反応、社会的相互作用といった重要な過程を人間と比較できる点で意義深いのです。
さらに、ゼブラフィッシュの社会的行動は幼少期から現れ、自然に群れ(shoal)を形成します。この行動は人間の社会的集まりと類似しており、群れ行動の変化は社会的動機づけ、注意、不安の変化を反映します14-16。これはASDにおいて重要な特徴です。加えて、ゼブラフィッシュの胚は透明であるため、生体の脳活動を先端的イメージング技術で可視化できます。特定のニューロンを標識し、行動中の神経活動を追跡できることから17,18、ASDにおける感覚入力処理の研究に特に有用です。
3.関連遺伝子変異を持つゼブラフィッシュは環境依存的に社会行動が変化するASDに関与する遺伝子の中で、UBE3Aはユビキチン-プロテインリガーゼE3Aをコードしており、脳細胞内のタンパク質代謝の調節に重要な役割を果たします。UBE3Aは不要または損傷したタンパク質にタグをつけて分解に導き、ニューロン同士が効率よく情報を伝達できるよう分子のバランスを維持します。母方染色体上のUBE3A機能喪失は、アンゲルマン症候群(AS)を引き起こし、知的障がい、運動障がい、てんかん、発語困難を特徴とします19。さらに、UBE3A変異はASDや関連する精神疾患とも関連しています20,21。ゼブラフィッシュにはヒトUBE3Aに相当する遺伝子が存在し、これを利用して研究が可能です(図2)。
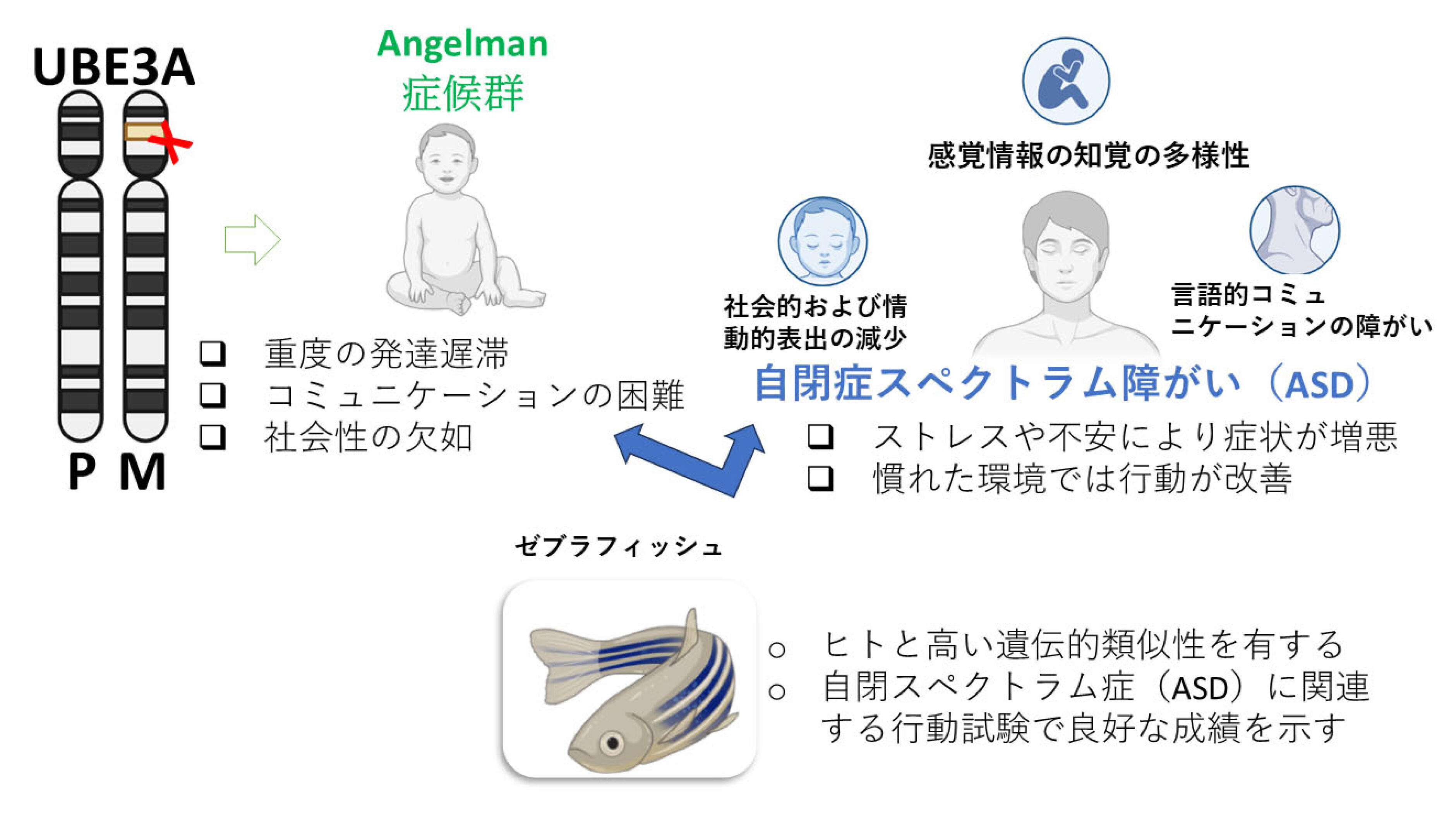
我々の最近の研究では、ube3a変異ゼブラフィッシュが不安様行動や社会行動の変化を示すことが明らかになりました22。特に、脅威的と認識される環境下で顕著でした。実験では2つの環境を用いました:①白色発泡スチロール箱(不規則な模様と反射光が多く、魚にとってストレス環境)、②透明のアクリル水槽(繁殖水槽と同様で均一な視覚環境)。変異魚を発泡スチロール環境に置くと社会的交流は低下し、遊泳が減り孤立傾向を示しました。しかし、アクリル水槽に置いた場合、社会行動は大きく改善し、野生型に近い行動を示しました(図3)。
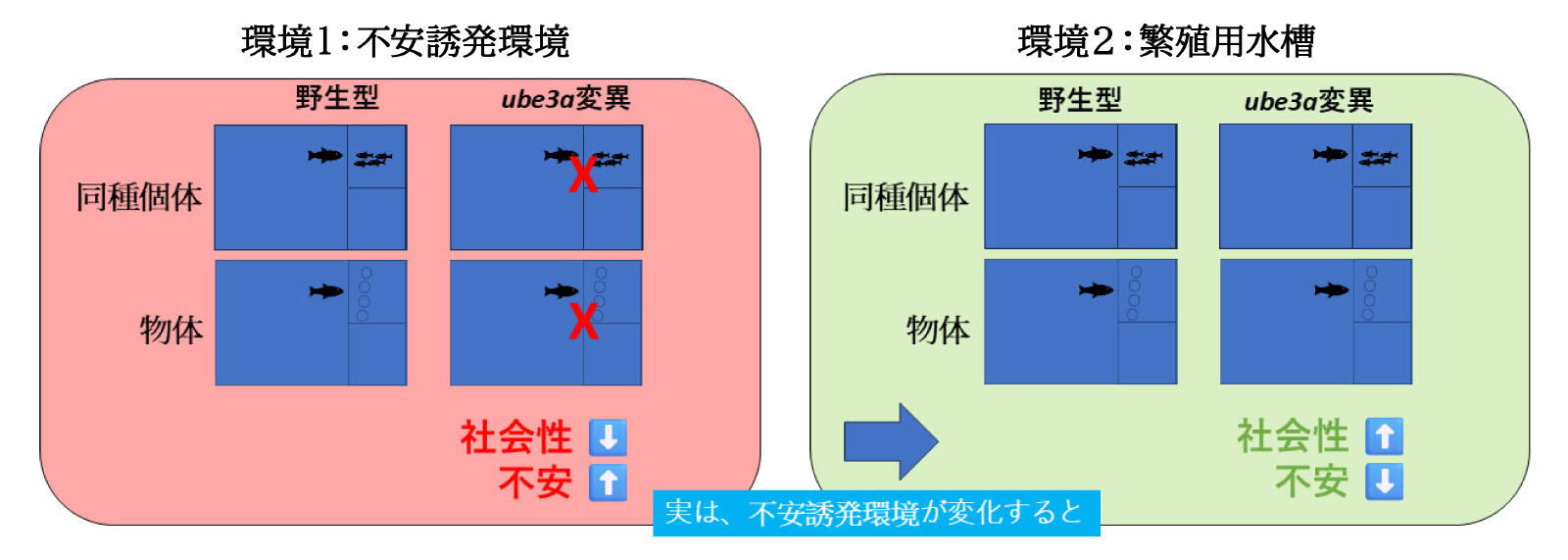
この実験は重要な示唆を与えます。すなわち、ストレス環境は行動障がいを増幅させ、一方で快適な環境はそれらを軽減または覆い隠す可能性があるということです。そこで私たちは、脳の活動パターンを可視化するためc-Fos in situハイブリダイゼーションを行い、さらにRNAシーケンスで遺伝子発現変化を解析しました。その結果、変異魚では特に視覚、感覚統合、情動制御に関わる脳領域で異常な活性化パターンが認められました。つまり、ube3a変異魚は環境をより脅威的に知覚し、不安や回避行動を引き起こしていたと考えられます。こうした研究を深めることで、ASDにおける遺伝的・環境的両側面を理解し、より個別化された治療戦略につながる可能性があります。
4.ヒトASDへの示唆前述のとおり、ASDの人々は光、音、触感に対して過敏であることが多く、一般的な教室やオフィス、店舗であっても、ASDの人には圧倒的で不快に感じられることがあります。ube3a変異ゼブラフィッシュに関する研究は、これは単なる性格や気分の問題ではなく、環境依存的な社会行動が神経生物学的差異や感覚情報処理の違いに根ざしている可能性を示唆しています。
この研究から見えてくるのは、「遺伝子が舞台を整え、環境が演劇を決定する」ということです。実際に、アクリル水槽が変異魚の社会性を改善したように、ASDの人々にとっても支援的で低ストレスな環境を整えることは、不安の軽減や社会的交流の促進につながる可能性があります。具体的には、静かな公共空間の設計、教室の視覚的整理、予測不可能な感覚入力の最小化などが考えられます。そのようにしてASDの人々の不安や不快を減らし、彼らがより安心して社会参加できる環境をつくることが可能かもしれません。
文献
- Kanner, L. Autistic disturbances of affective contact. Acta Paedopsychiatr 35, 100-36 (1968).
- Genovese, A. & Butler, M. G. Clinical Assessment, Genetics, and Treatment Approaches in Autism Spectrum Disorder (ASD). Int J Mol Sci 21, 4726 (2020).
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. Diagnostic and Statistical Manual of Mental Disorders (2013).
- World Health Organization. ICD-10: international statistical classification of diseases and related health problems: tenth revision. InICD-10: International statistical classification of diseases and related health problems: Tenth revision 2004.
- Lyall, K. et al. The Changing Epidemiology of Autism Spectrum Disorders. Annu Rev Public Health 38, 81-102 (2017).
- Dougnon, G. & Matsui, H. Modelling Autism Spectrum Disorder (ASD) and Attention-Deficit/Hyperactivity Disorder (ADHD) Using Mice and Zebrafish. Int J Mol Sci 23, 7550 (2022).
- Nisar, S. et al. Association of genes with phenotype in autism spectrum disorder. Aging (Albany NY) 11, 10742 (2019).
- Iwata, K. et al. Genome-wide DNA methylation profiles in the raphe nuclei of patients with autism spectrum disorder. Psychiatry Clin Neurosci 79, 415-424 (2025).
- Wilfert, A. B. et al. Recent ultra-rare inherited variants implicate new autism candidate risk genes. Nature Genetics 53, 1125-1134 (2021).
- Havdahl, A. et al. Genetic contributions to autism spectrum disorder. Psychol Med 51, 2260 (2021).
- Teame, T. et al. The use of zebrafish (Danio rerio) as biomedical models. Anim Front 9, 68 (2019).
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K. & Kim, C. H. Zebrafish as an animal model for biomedical research. Experimental & Mol Med 53, 310-317 (2021).
- Verma, R., Raj Choudhary, P., Kumar Nirmal, N., Syed, F. & Verma, R. Neurotransmitter systems in zebrafish model as a target for neurobehavioural studies. Mater Today Proc 69, 1565-1580 (2022).
- Bonan, C. D. & Norton, W. H. J. The utility of zebrafish as a model for behavioural genetics. Curr Opin Behav Sci 2, 34-38 (2015).
- Corcoran, J., Storks, L. & Wong, R. Y. Bold zebrafish (Danio rerio) learn faster in a classical associative learning task. Sci. Rep. 15, 1-11 (2025).
- Baker, M. R. & Wong, R. Y. Contextual fear learning and memory differ between stress coping styles in zebrafish. Sci. Rep. 9, 9935 (2019).
- Randlett, O. et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods 12, 1039-1046 (2015).
- Weinschutz Mendes, H. et al. High-throughput functional analysis of autism genes in zebrafish identifies convergence in dopaminergic and neuroimmune pathways. Cell Rep 42, 112243 (2023).
- Williams, C. A. et al. Angelman syndrome 2005: updated consensus for diagnostic criteria. Am J Med Genet A 140, 413-418 (2006).
- Sun, J. et al. UBE3A regulates synaptic plasticity and learning and memory by controlling SK2 channel endocytosis. Cell Rep 12, 449 (2015).
- Roy, B., Amemasor, E., Hussain, S. & Castro, K. UBE3A: The Role in Autism Spectrum Disorders (ASDs) and a Potential Candidate for Biomarker Studies and Designing Therapeutic Strategies. Diseases 12, 7 (2023).
- Dougnon, G. & Matsui, H. Environmental context modulates sociability in ube3a zebrafish mutants via alterations in sensory pathways. Mol Psychiatry 1-15 (2025).





