2025年3月31日公開
担当:中島章博 先生
所属:脳神経内科学分野
中枢神経である脳と脊髄は、髄膜と呼ばれる特殊な膜に包まれており、これにより機械的な衝撃や感染症などから保護されている。近年、髄膜生物学(meningeal biology)に関する研究が進み、中枢神経の老廃物除去や免疫監視機能を持つことで中枢神経の恒常性維持に重要な役割を果たしていることが明らかになってきた。本稿では、最新の知見を踏まえ、「髄膜生物学」研究の魅力を紹介する。
2.髄膜の基本構造とその役割髄膜(meninges)は、外側から順に硬膜(dura mater)、くも膜(arachnoid mater)、軟膜(pia mater)の3層からなる結合組織で構成されている1。硬膜は最も外側の頭蓋骨や椎骨の内面に付着し、厚く丈夫な膜で機械的な強度を持っている。これにより外部からの物理的衝撃を緩衝する。その内側にあるくも膜は、巣状の構造を持ち、中枢神経の重要なバリアを形成する。くも膜の内側には、くも膜下腔が広がり、脳脊髄液と少数の常在免疫細胞が存在する。最も内側の軟膜は、脳や脊髄の表面に密着する。軟膜に接し、アストロサイト(グリア細胞の一つ)の足突起は、glia limitansという薄い層を形成している。
硬膜はさらに3つの層構造をもつ。最外層(outer dural border layer)は、頭蓋骨と接する比較的薄い層である。中間層(meningeal layer)は、線維芽細胞に富み、機械的な強度を提供する。最内層(dural border cell layer: DBC layer)は、細胞接合部が少ない形で、くも膜と接する。硬膜には、線維芽細胞、境界マクロファージ(border-associated macrophage)を含む組織常在免疫細胞の他、柵状の毛細血管が存在する。硬膜とくも膜の間には、密なタイトジャンクションを有するくも膜バリア細胞(arachnoid barrier cells)層が存在し、血液くも膜関門(blood-arachnoid barrier)を形成することで、形態的・生理的なバリアとして機能している。一方、脳特有のバリア機能として広く知られる血液脳関門(blood-brain barrier: BBB)は、血管内皮細胞によって構成され、分子や細胞の移動を厳密に制御している。硬膜には、硬膜の内側に血液くも膜関門があることで、クモ膜下腔への病原体の侵入を防いでいる。
3.近年の髄膜生物学における新たな知見中枢神経は、前述のBBBや血液くも膜関門によって外界と隔てられているため、中枢神経で生成された老廃物をどのように排出するのか、中枢神経へ感染が波及していないのか(免疫監視)は、重要な論点である。従来、中枢神経実質にはリンパ管が存在せず、古典的なリンパ液の流れがないと考えられてきたが、近年の髄膜生物学における新たな知見により、髄膜による中枢神経の老廃物除去と免疫監視の仕組みが明らかになりつつある。
脳脊髄液は、くも膜下腔からVirchow-Robin腔と呼ばれる血管周囲腔に流れ、アストロサイトの水チャネルであるアクアポリン4を介して脳実質内へと移行する。脳実質内では間質液と混合し、神経細胞から放出された異常蛋白質などを回収したのち、再び脳脊髄液中に放出される。このように、リンパの流れに類似した脳の浄化機構が存在し、グリア細胞(アストロサイト)によって担われていることから、glymphatic systemと称される。近年の研究により、硬膜にはリンパ管(硬膜リンパ管)が存在し、そこから末梢の頸部リンパ節に排出されていることが明らかとなった。これらglymphatic systemと髄膜構造を介した脳の浄化機能・免疫監視機能を、併せてglymphatic-lymphatic systemと称される2。この浄化機能と免疫監視機能は脳の恒常性維持において重要な役割を果たしており、各疾患の病態と関連している。例えば、アルツハイマー病は、アミロイドβとタウといったタンパク質が異常に脳内に蓄積することで生じる。これらのタンパク質の排出機構を制御できるようになれば、アルツハイマー病に対する新たな治療戦略となるであろう3。このため、glymphatic-lymphatic systemの全容解明が求められている2,4。
免疫細胞の移動を担うACEポイント血液くも膜関門を越えて、くも膜下腔と硬膜の間を液体や分子がどのように行き来するのかは、長らく不明であった。近年、実験動物モデルを用いたトレーサー実験により、血液くも膜関門が一部で中断され、液体や分子の通過が可能なACEポイント(arachnoid cuff exit points)と呼ばれる構造が存在することが明らかとなった5。中枢神経で生じた老廃物は、ACEポイントを介して、くも膜下腔から硬膜リンパ管へ排出されると考えられている。また、実験的自己免疫性脳脊髄炎モデル動物においては、ACEポイントが細胞輸送を可能にし、免疫細胞が硬膜からくも膜下腔へ直接進入する経路となることが示されている。よって、ACEポイントは、免疫細胞の移動に関与する重要な経路であると考えられている。
脳をパトロールする硬膜関連リンパ組織(DALT)近年、齧歯類の硬膜研究により、脳をパトロールする硬膜関連リンパ組織(dura-associated lymphoid tissue: DALT)の存在が明らかとなっている6。外部環境と直接接触する気道、腸、皮膚などの臓器には、局所免疫応答の開始と迅速な防御機能を担う二次リンパ組織様構造が存在する。DALTもこれらと類似した構造を持つ。実際に、実験動物モデルに鼻からある種のウィルスが侵入する際には、DALTの免疫細胞が活性化する。硬膜は、末梢の循環血液にさらされるものの、BBBを欠き、さらにはACEポイントによりくも膜下腔へと一部交通している。DALTがパトロールすることで、中枢神経の免疫監視に寄与する可能性が考えられている。
髄膜は近傍の骨髄から、恒常的な免疫細胞の供給を受ける中枢神経の炎症性疾患・自己免疫疾患もしくは変性疾患では、多くの免疫細胞が中枢神経に浸潤している。一方、その免疫細胞がどこから供給されるかは、不明であった。齧歯類では、髄膜に存在する好中球、単球、B細胞といった免疫細胞は、循環している血液ではなく、隣接する頭蓋骨や椎骨の骨髄由来である可能性が指摘されている6。つまり、硬膜は近傍の頭蓋や脊椎の骨髄と連携をとり、中枢神経独自の免疫ネットワークを構築していると考えるべきである。
免疫介在性肥厚性硬膜炎(immune-mediated hypertrophic pachymeningitis)は、炎症により硬膜が異常に肥厚する疾患である。頭蓋の肥厚性硬膜炎では頭痛や脳神経麻痺が認められることが多く、脊椎の肥厚性硬膜炎では脊髄障害をきたす。診断にはMRIによる硬膜の造影効果を評価し、背景にある疾患の検索が必要である。肥厚性硬膜炎は、歴史的には梅毒などの感染症の頻度が多かったが、現在は自己免疫疾患を背景にもつ場合が多い。我々は、自己免疫介在性肥厚性硬膜炎の中で、抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody: ANCA)が陽性となることが多いこと、病理学的に肉芽腫性炎症や血管炎を呈することを報告してきた7。2025年には、長期観察期間を経た臨床解析にて、脊椎肥厚性硬膜炎ではときに緊急減圧術を併用することを検討しながら、ANCA関連血管炎への免疫治療を行うべきであることを報告してきた8。
脊椎肥厚性硬膜炎の病理放射線学的解析によって、ミエロプロテアーゼ(MPO)-ANCA陽性の肥厚性硬膜炎では、肥厚した硬膜の脊髄側では脊髄に物理的な圧迫は認めるものの、くも膜下腔やその内側の脊髄実質には、直接炎症の波及を認めなかった(図1-3)8。一方、肥厚した硬膜の外側にある脊椎骨には容易に炎症が及ぶ。このことは、血液くも膜関門によるバリア機能が強固であること1、一方、硬膜は脊椎骨(骨髄)と硬膜がチャネルを持つことで連携して免疫細胞を動員することを示している6,9。この結果は、齧歯類動物モデルで明らかになったmeningeal biologyの最新知見を裏付けるものであった。
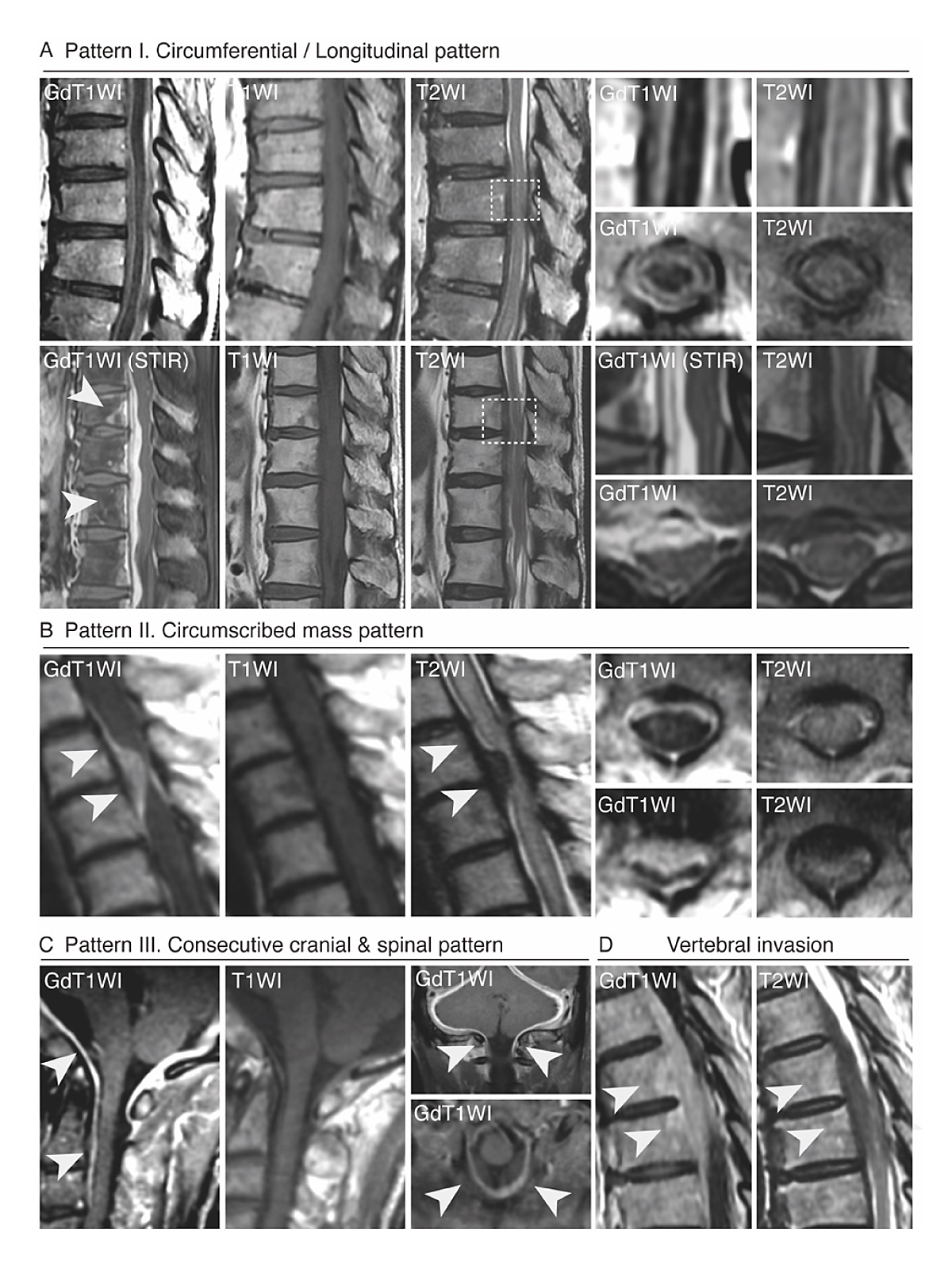
(画像はNakajima A, et al. Neurology 20258から改変して引用)
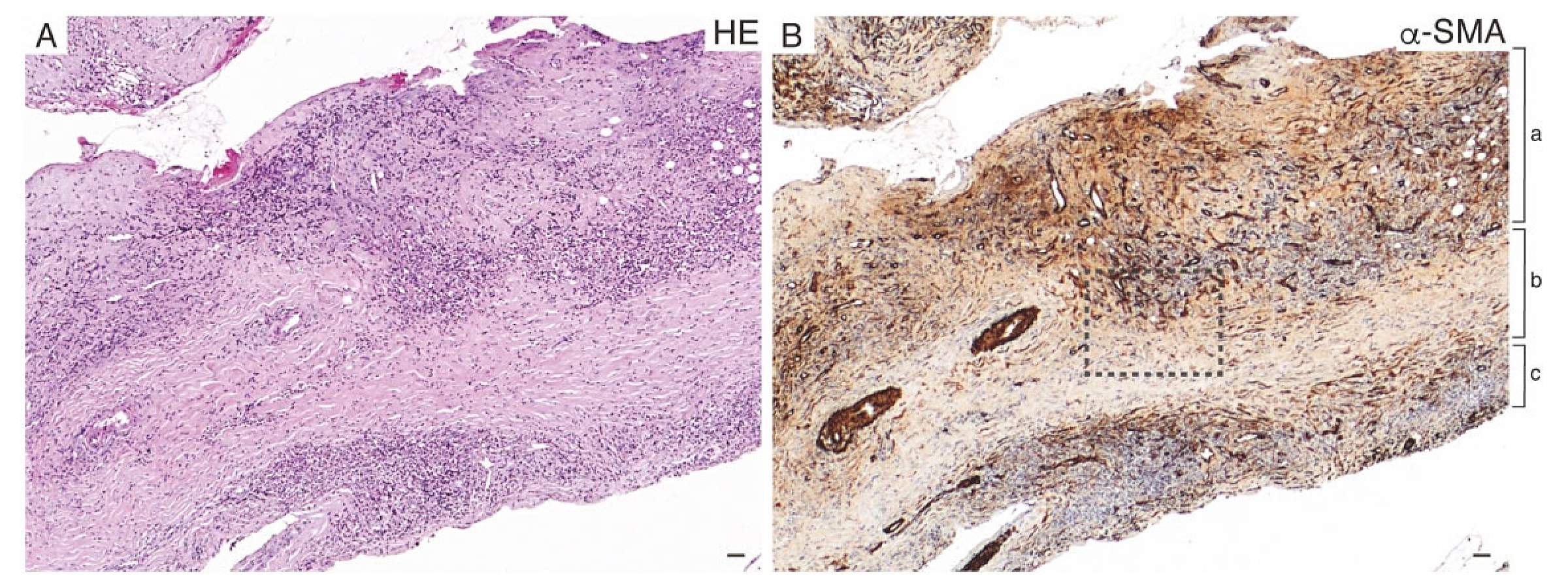
(画像はNakajima A, et al. Neurology 20258からの引用)
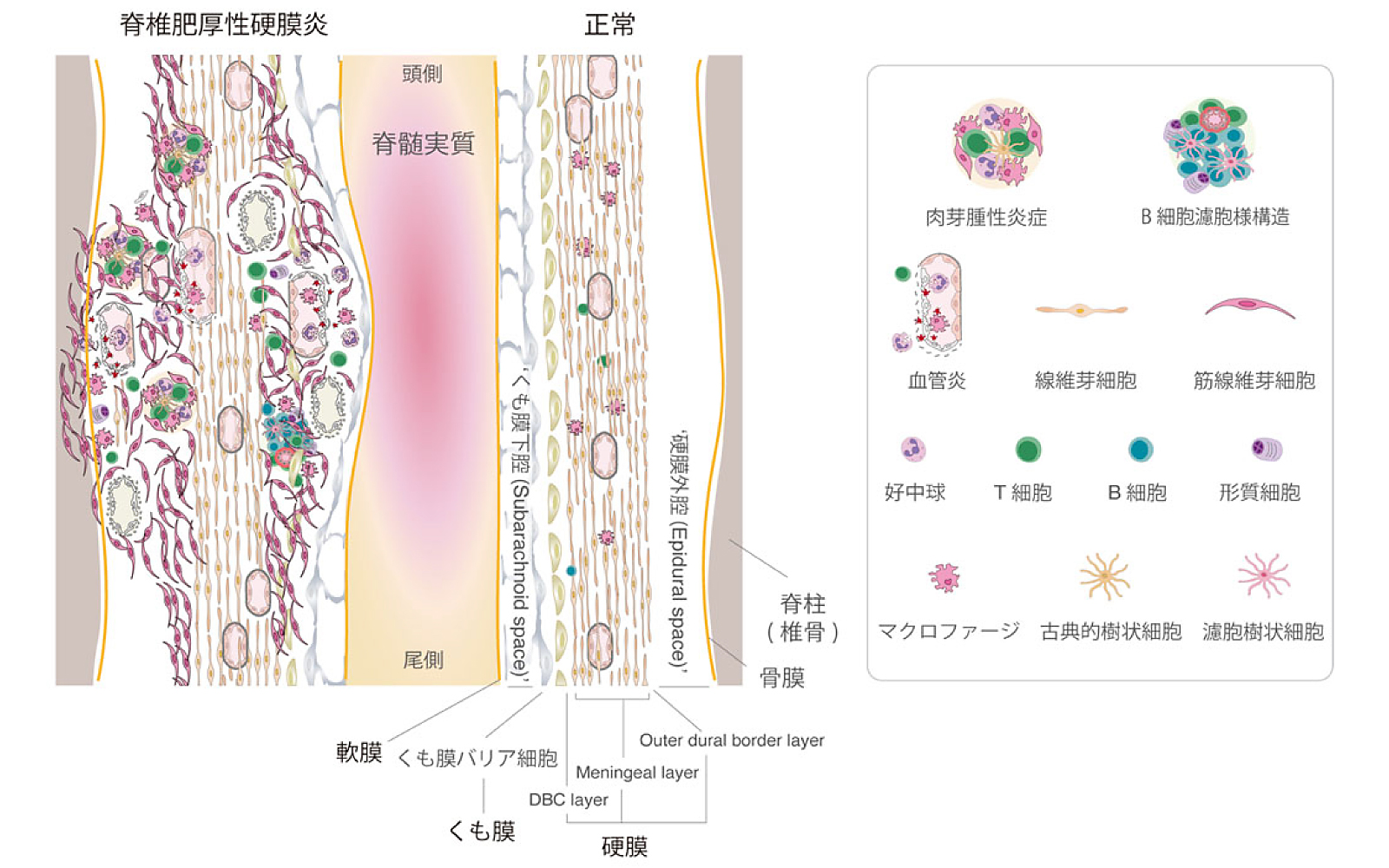
(画像はNakajima A, et al. Neurology 20258から改変して引用)
MPO-ANCA陽性の頭蓋肥厚性硬膜炎は、慢性副鼻腔炎もしくは中耳炎/乳様突起炎といった上気道の炎症の合併を認める。一方、脊椎肥厚性硬膜炎の患者は、上気道炎症の合併は低い7,8。中耳の炎症は、翼状静脈叢などの静脈を介して静脈洞に至り、硬膜へ波及することが可能である。そのため、上気道炎症は硬膜への炎症メディエーターの供給源となる可能性がある。
5.髄膜生物学研究の今後の展望齧歯類の動物モデルを中心に発展してきた髄膜生物学研究は、益々、魅力的な分野に成長している。中枢神経の恒常性維持に関する新たな知見として、ACEポイント、DALT、骨髄と硬膜の連携が次第に明らかとなっている。肥厚性硬膜炎や多発性硬化症などの神経免疫疾患を持つ患者さんでの解析10-14や、アルツハイマー病などの神経変性疾患を持つ患者さんでの解析を通じて、髄膜生物学のさらなる理解を深め、新たな知見を得ることを目指したい。
参考文献
- Betsholtz C, Engelhardt B, Koh GY, McDonald DM, Proulx ST, Siegenthaler J. Advances and controversies in meningeal biology. Nat Neurosci. 2024. doi:10.1038/s41593-024-01701-8
- Kipnis J. The anatomy of brainwashing. Science. 2024;385(6707):368-370. doi:10.1126/science.adp1705
- Ishida K, Yamada K, Nishiyama R, Hashimoto T, Nishida I, Abe Y, Yasui M, Iwatsubo T. Glymphatic system clears extracellular tau and protects from tau aggregation and neurodegeneration. The Journal of experimental medicine. 2022;219(3). doi:10.1084/jem.20211275
- Yamada K, Iwatsubo T. Involvement of the glymphatic/meningeal lymphatic system in Alzheimer's disease: insights into proteostasis and future directions. Cell Mol Life Sci. 2024;81(1):192. doi:10.1007/s00018-024-05225-z
- Smyth LCD, Xu D, Okar SV, Dykstra T, Rustenhoven J, Papadopoulos Z, Bhasiin K, Kim MW, Drieu A, Mamuladze T, Blackburn S, Gu X, Gaitán MI, Nair G, Storck SE, Du S, White MA, Bayguinov P, Smirnov I, Dikranian K, Reich DS, Kipnis J. Identification of direct connections between the dura and the brain. Nature. 2024;627(8002):165-173. doi:10.1038/s41586-023-06993-7
- Brioschi S, Wang WL, Peng V, Wang M, Shchukina I, Greenberg ZJ, Bando JK, Jaeger N, Czepielewski RS, Swain A, Mogilenko DA, Beatty WL, Bayguinov P, Fitzpatrick JAJ, Schuettpelz LG, Fronick CC, Smirnov I, Kipnis J, Shapiro VS, Wu GF, Gilfillan S, Cella M, Artyomov MN, Kleinstein SH, Colonna M. Heterogeneity of meningeal B cells reveals a lymphopoietic niche at the CNS borders. Science. 2021;373(6553). doi:10.1126/science.abf9277
- Yokoseki A, Saji E, Arakawa M, Kosaka T, Hokari M, Toyoshima Y, Okamoto K, Takeda S, Sanpei K, Kikuchi H, Hirohata S, Akazawa K, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Hypertrophic pachymeningitis: significance of myeloperoxidase anti-neutrophil cytoplasmic antibody. Brain : a journal of neurology. 2014;137(Pt 2):520-536. doi:10.1093/brain/awt314 (新潟大学の知見)
- Nakajima A, Hokari M, Yanagimura F, Saji E, Shimizu H, Toyoshima Y, Yanagawa K, Arakawa M, Yokoseki A, Wakasugi T, Okamoto K, Watanabe K, Minato K, Otsu Y, Nozawa Y, Kobayashi D, Sanpei K, Kikuchi H, Hirohata S, Awamori K, Nawata A, Yamada M, Takahashi H, Nishizawa M, Igarashi H, Sato N, Kakita A, Onodera O, Kawachi I. Long-Term Clinical Landscapes of Spinal Hypertrophic Pachymeningitis With Anti-Neutrophil Cytoplasmic Antibody-Associated Vasculitis. Neurology. 2025;104(8):e213420. doi:10.1212/WNL.0000000000213420 (新潟大学の知見)
- Cugurra A, Mamuladze T, Rustenhoven J, Dykstra T, Beroshvili G, Greenberg ZJ, Baker W, Papadopoulos Z, Drieu A, Blackburn S, Kanamori M, Brioschi S, Herz J, Schuettpelz LG, Colonna M, Smirnov I, Kipnis J. Skull and vertebral bone marrow are myeloid cell reservoirs for the meninges and CNS parenchyma. Science. 2021;373(6553). doi:10.1126/science.abf7844
- Yanagawa K, Kawachi I, Toyoshima Y, Yokoseki A, Arakawa M, Hasegawa A, Ito T, Kojima N, Koike R, Tanaka K, Kosaka T, Tan CF, Kakita A, Okamoto K, Tsujita M, Sakimura K, Takahashi H, Nishizawa M. Pathologic and immunologic profiles of a limited form of neuromyelitis optica with myelitis. Neurology. 2009;73(20):1628-1637. doi:10.1212/WNL.0b013e3181c1deb9 (新潟大学の知見)
- Saji E, Arakawa M, Yanagawa K, Toyoshima Y, Yokoseki A, Okamoto K, Otsuki M, Akazawa K, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Cognitive impairment and cortical degeneration in neuromyelitis optica. Ann Neurol. 2013;73(1):65-76. doi:10.1002/ana.23721 (新潟大学の知見)
- Yokoseki A, Saji E, Arakawa M, Hokari M, Ishiguro T, Yanagimura F, Ishihara T, Okamoto K, Nishizawa M, Kawachi I. Relapse of multiple sclerosis in a patient retaining CCR7-expressing T cells in CSF under fingolimod therapy. Multiple sclerosis. 2013;19(9):1230-1233. doi:10.1177/1352458513481395 (新潟大学の知見)
- Hokari M, Yokoseki A, Arakawa M, Saji E, Yanagawa K, Yanagimura F, Toyoshima Y, Okamoto K, Ueki S, Hatase T, Ohashi R, Fukuchi T, Akazawa K, Yamada M, Kakita A, Takahashi H, Nishizawa M, Kawachi I. Clinicopathological features in anterior visual pathway in neuromyelitis optica. Ann Neurol. 2016;79(4):605-624. doi:10.1002/ana.24608 (新潟大学の知見)
- Kawachi I, Lassmann H. Neurodegeneration in multiple sclerosis and neuromyelitis optica. Journal of neurology, neurosurgery, and psychiatry. 2017;88(2):137-145. doi:10.1136/jnnp-2016-313300 (新潟大学の知見)





