2024年9月2日公開
担当:田井中一貴 先生
所属:システム脳病態学分野 田井中研究室
頭痛に悩まされているあなたは、頭痛が始まるとイヤホン型の装置を左の耳に装着する。すると、痛みが和らぎ、気づけば頭痛から解放されている。あるいは、朝目覚めてイヤホン型の装置を左の耳に装着し、朝食を取りコーヒーを飲みながらニュースに目を通す。仕事を始めると、普段よりも頭が冴えパフォーマンスが向上しているようだ。もし、そのような装置が存在すれば、誰もが使いたくなるのではないだろうか?今回のコラムでは、そのような可能性を秘めた経皮的耳介迷走神経刺激(taVNS)を紹介する。
炎症刺激が神経経路を活性化し、視床下部に情報を伝達することで、抗炎症反応が迅速かつ無意識に起こる「炎症反射」がケビン・トレイシー博士により発見された[1]。この原理を応用し、人為的に迷走神経を刺激することで、過剰な免疫反応や組織損傷が持続する関節リウマチなどの症状を改善させることができる[2]。本邦においても難治性てんかん患者に対して、頸部の迷走神経に電極を直接取り付ける埋め込み型の迷走神経刺激装置により、てんかん発作を減少させる治療法として適応されている。
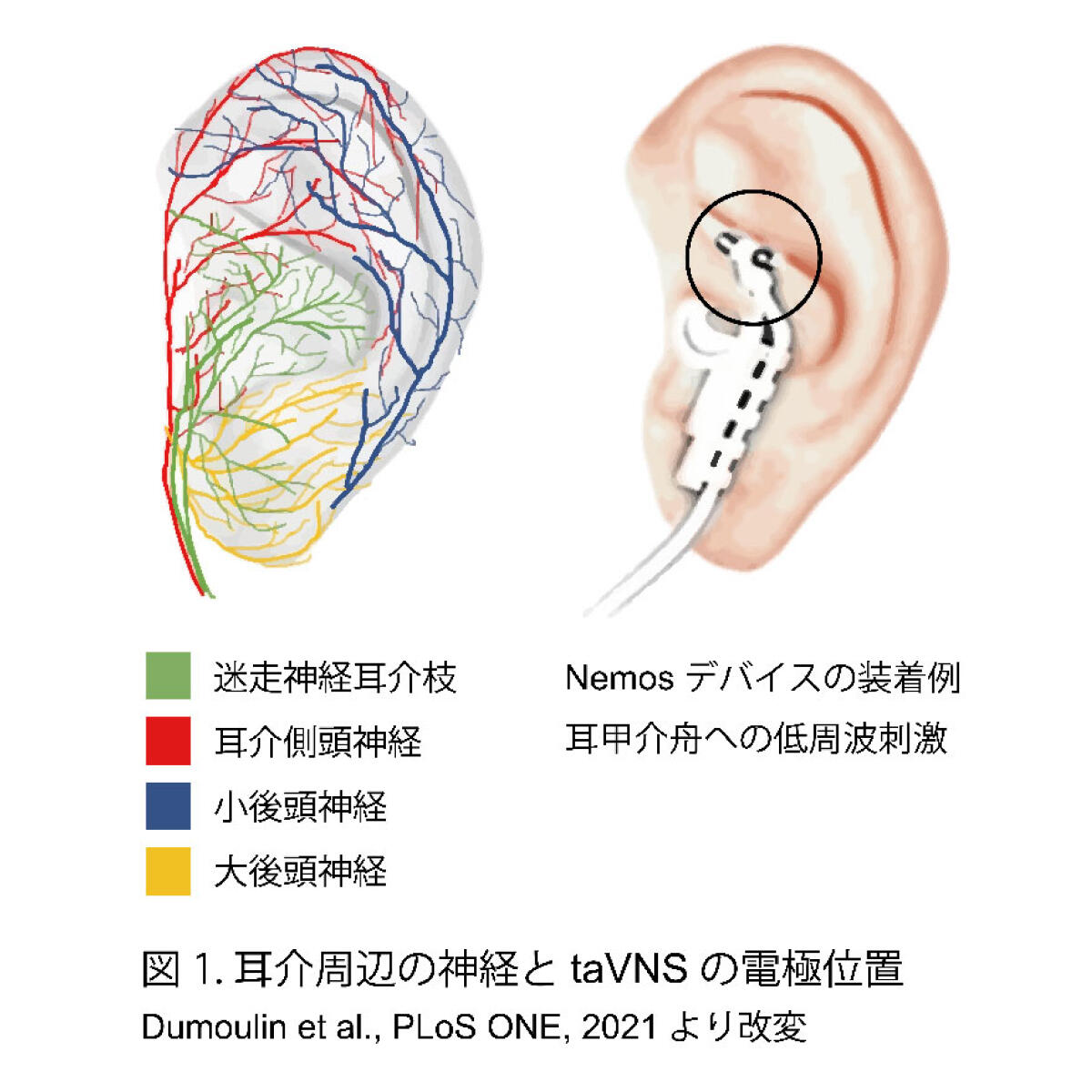
しかしながら、埋め込み型の刺激装置は外科的手術が必要なため侵襲性が高い。そこで、より侵襲性の低い迷走神経刺激のアプローチが検討された。19世紀に耳介の外耳道の刺激によって咳反射を引き起こす「アーノルド反射」が発見され、その後の解剖学的な研究により、耳介が迷走神経によって支配されていることが明らかになった[3]。炎症反射に基づく迷走神経刺激療法の発見から、低周波刺激装置を耳甲介に取り付ける低侵襲性の経皮的耳介迷走神経刺激(taVNS)が開発されるに至った(図1)[4]。
現在、taVNSに広く使用されている低周波刺激装置は、肩こりの解消やマッサージ効果が期待できる低周波治療器と同様の装置を用い、耳介に痛みを感じない程度の低周波刺激によって行われる。なお、taVNSでは迷走神経の影響が限定的な耳たぶへの低周波刺激がsham刺激として実施される。迷走神経耳介枝への低周波刺激により、心拍数の減少[5]、血圧の低下[6]、自律神経指標の改善[7]、消化管運動の促進[8]など、遠心性の迷走神経に関連する様々な自律神経系に良好な影響を及ぼすことが知られている。我々の研究グループにおいても健常男性を対象に心拍と血圧の同時計測を実施した結果、刺激直後に心拍数が有意に低下すること、収縮期血圧が有意に増加することを確認した[9]。また、Mayer波帯域における血圧から心拍数までの最大相関係数ρmaxを計測した結果、刺激によりρmaxが有意に増加し、刺激後も持続的に維持されることを見出した。これは、taVNSが自律神経系の正常な調節機能を促進する効果があることを意味している。
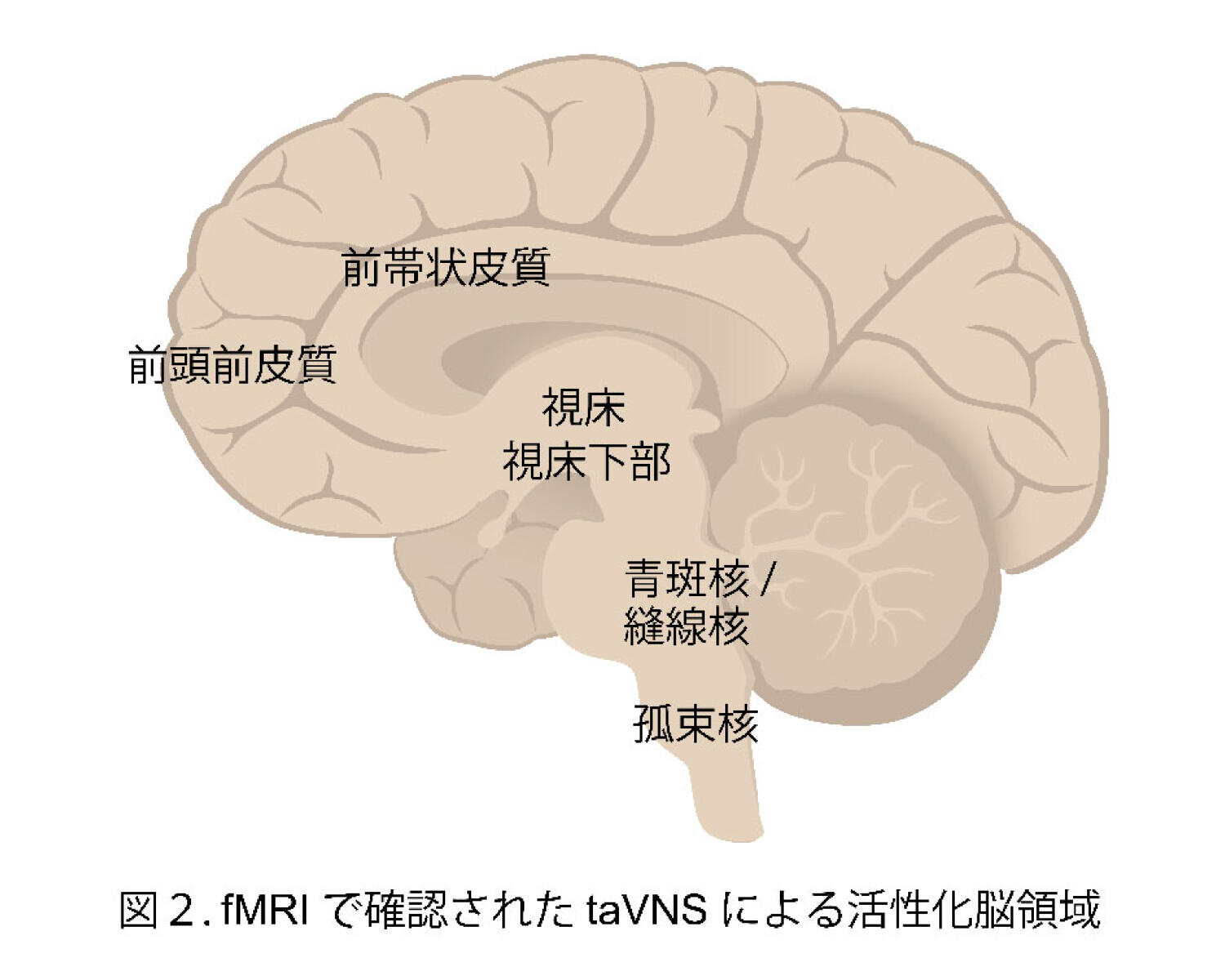
taVNSによる末梢への影響に加えて、fMRI(機能的磁気共鳴画像法)を用いた複数の研究により、耳介迷走神経への低周波刺激がどのような脳領域を活性化しているかが検証された。その結果、求心性の迷走神経経路となる延髄の孤束核、脳幹の青斑核および縫線核に加えて、間脳の視床および視床下部、皮質の前帯状皮質および前頭前皮質など、広範な脳領域での活性化が誘導されることが分かった(図2)[10]。これらの領域は、注意、感情調節、意思決定、自己制御などの高次認知機能に関与しており、taVNSがこれらの機能に対してポジティブな影響を与える可能性を示している。
過剰な免疫反応に関連する広範な疾患への応用が検討されており、代表的な例をいくつか紹介する。中程度から重度の関節リウマチ患者におけるパイロット研究では、非盲検試験であることを考慮する必要があるものの、37%の被験者でリウマチ活動性指標の低下が認められた[11]。また、慢性偏頭痛患者に対するランダム化二重盲検比較試験では、小規模の研究ではあるものの、頭痛日数が28日間で平均7.0日減少することが分かった[12]。新型コロナウィルス感染症の罹患後症状(後遺症)を有する女性の被験者を対象とした小規模のパイロット研究(ランダム化二重盲検比較試験)では、taVNS治療の10日間にわたり、嗅覚を除く全ての評価項目(認知機能、不安、抑うつ、睡眠、疲労)にわたって有意な改善が認められた[13]。薬剤抵抗性のてんかん患者に対するパイロット研究(ランダム化二重盲検比較試験)では、20週間の治療期間を完了した患者では、発作頻度が34.2%有意に減少した[14]。本邦においても、認知機能が保たれた構造的焦点てんかん患者に対する症例が報告されており、taVNSによりてんかん発作回数が顕著に減少した[15]。
fMRIの研究から想定される脳内への影響をベースに、taVNSは様々な認知機能に対する介入効果が検証されている。健康な若年成人を対象としたtaVNS刺激直後の作業記憶に対する効果を評価した研究では、数字作業記憶タスクにおいては明確な効果が見られなかったものの、空間作業記憶(道を覚えたり、物を見つけたりする際の能力)は有意に改善する可能性が示された[16]。また、顔画像認識タスクを用いて感情認識能力への効果を評価した結果、taVNSにより感情認識のスピード・精度が向上することが示された[17]。また、taVNSの創造的パフォーマンスへの影響を調べた結果、短時間で多くのアイデアを生成する流暢性、異なる視点やアプローチを取り入れる柔軟性、独自の新しい斬新なアイデアを生み出す独創性に関連する拡散的思考を強化する可能性が示された[18]。一方、明確な答えが求められる状況や、問題解決の過程で効率的に結果を出すために重要な収束的思考には明瞭な差が認められなかった。抑制制御プロセスに関する評価を行った結果、バックワード抑制プロセス(あるタスクから別のタスクに切り替えるときに、前のタスクを抑制するプロセス)には効果が認められなかったものの、特定の行動や反応を抑える応答抑制プロセス、つまり、間違った反応の数が減少することが分かった[19]。この結果は、taVNSには作業中、反射的に起こる反応や強い欲求を抑える可能性があることを示唆している。また、英語を母語とする成人に対して、ヘブライ語の文字と音の関係を学習する能力を調査したところ、新しい文字と音の対応関係を処理する能力を向上させ、新しい単語を正確に音読する能力を向上させることが分かった[20]。
健康な高齢者を対象とした連想記憶(人の顔とその名前を一緒に覚える、ある出来事とそれが起こった場所を関連付けるなどの能力)に関するパフォーマンスを評価した結果、連想記憶の形成と想起を改善する効果が認められた[21]。また、軽度認知障害(MCI)の患者の認知機能への効果を評価した小規模のパイロット研究(ランダム化二重盲検比較試験)では、様々な評価項目で認知機能の有意な改善が認められた[22]。
一つのデバイスで過剰な免疫の暴走を抑えるばかりか、様々な認知機能の向上に関するポテンシャルが明らかになりつつあるため、本邦では未だ限定的であるものの、taVNSに関する世界的な関心が高まっている。モバイル性があるため自宅や職場でも利用可能であり、英国で販売されているNurosymが10万円程度で購入可能であることから、この価格は既に広く使用されている低周波刺激装置を改良することで更なる低コスト化が見込めるため、今後、本邦においても広く普及することが予想される。一方で、今回紹介した一連の論文は全て小規模の研究成果であり、今後の大規模な臨床研究が期待される。また、taVNSの効果には大きな個人差があることに注意が必要である。加えて、現時点では大きな有害事例は報告されていないものの、今後利用が拡大するにつれ、問題が発生する可能性もある。副交感神経優位の被験者や電気的刺激に感受性の高い被験者にとっては、むしろ逆効果になる可能性がありえることを考慮する必要がある。従って、今後もtaVNSのパラメータの最適化のみならず、taVNSに適合する被験者の基準の明確化、個人に最適化可能なパラメータ設定法など、いくつもの課題をクリアしなければならない。また、taVNSに適した被験者のみがこの装置を活用し、認知機能を向上させた場合、適合しない被験者との間に能力格差が生み出される懸念もある。更には、taVNSの研究効果を援用(悪用)して、エビデンスの伴わない怪しげな広告が現れる可能性も否定できない。検証段階の今のうちに、将来的な懸念を未然に防ぐガイドラインの策定が必要かもしれない。とはいえ、高齢者の認知機能の改善にもポテンシャルのあるtaVNSは費用対効果も高く、超高齢化社会の本邦においては重要なツールになる可能性が高い。引き続き、taVNSの動向に注視したい。
文献
- Tracey et al., Nature, 2002, 420(6917), 853-9. doi: 10.1038/nature01321.
- Koopman et al., Proc. Natl. Acad. Sci. U. S. A., 2016, 113(29), 8284-9. doi: 10.1073/pnas.1605635113.
- He et al., Evid. Based Complement. Alternat. Med., 2012, 2012, 786839. doi: 10.1155/2012/786839.
- Dumoulin et al., PLoS ONE, 2021, 16(7), e0254480. doi: 10.1371/journal.pone.0254480.
- Badran et al., Brain Stimul., 2018, 11(4), 699-708. doi: 10.1016/j.brs.2018.04.004.
- de Moraes et al., Bioelectron. Med., 2023, 9(1), 7. doi: 10.1186/s42234-023-00109-2.
- Machetanz et al., Auton. Neurosci., 2021, 236, 102894. doi: 10.1016/j.autneu.2021.102894
- Steidel et al., Brain Stimul., 2021, 14(5), 1126-1132. doi: 10.1016/j.brs.2021.06.006.
- Katahara et al., 現在論文投稿中
- Badran et al., Brain Stimul., 2018, 11(3), 492-500. doi: 10.1016/j.brs.2017.12.009.
- Marsal et al., Lancet Rheumatol., 2021, 3(4), e262-e269. doi: 10.1016/S2665-9913(20)30425-2.
- Straube et al., J. Headache Pain, 2015, 16, 543. doi: 10.1186/s10194-015-0543-3.
- Zheng et al., Front. Neurol., 2024, 15, 1393371. doi: 10.3389/fneur.2024.1393371
- Bauer et al., Brain Stimul., 2016, 9(3), 356-363. doi: 10.1016/j.brs.2015.11.003.
- Shiraishi et al., Brain Dev., 2024, 46(1), 49-56. doi: 10.1016/j.braindev.2023.08.007.
- Sun et al., Front. Neurosci., 2021, 15, 790793. doi: 10.3389/fnins.2021.790793.
- Colzato et al., Cortex, 2017, 92, 95-102. doi: 10.1016/j.cortex.2017.03.017.
- Colzato et al., Neuropsychologia, 2018, 111, 72-76. doi: 10.1016/j.neuropsychologia.2018.01.003.
- Beste et al., Brain Stimul., 2016, 9(6), 811-818. doi: 10.1016/j.brs.2016.07.004.
- Thakkar et al., Brain Stimul., 2020, 13(6), 1813-1820. doi: 10.1016/j.brs.2020.10.012.
- Jacobs et al., Neurobiol. Aging, 2015, 36(5), 1860-7. doi: 10.1016/j.neurobiolaging.2015.02.023.
- Wang et al., Brain Stimul., 2022, 15(6), 1405-1414. doi: 10.1016/j.brs.2022.09.003.





