2024年3月11日公開
担当:濱崎英臣先生
所属:病理学分野
ポイント
- Tauopathyとは、Tauタンパクという細胞骨格を形成する重要なタンパクが異常に沈着する疾患の総称です。
- Tauの異常沈着はTauopathyごとに様々な形態をとり、診断のホールマークとなります。
- 筋強直性ジストロフィーは加齢性変化の早発と疾患特異的な3R tauopathyを呈します。
神経病理学とはどんな分野かご存知でしょうか?最近のグレイトギフトや2016年のフラジャイルといったドラマのおかげで病理学という分野の認知度が上がり、顕微鏡を覗き込み診断を行っているイメージが湧く方もいらっしゃるかもしれません。病理学分野では手術標本や剖検させていただいた症例の診断を行うために、組織標本上で診断根拠となる証拠を探します。神経病理学分野はその中でも神経系のスペシャリストの集団で、多様な認知症やてんかん、脳腫瘍などの神経系の病気の診断に携わり、原因究明のため研究を行っています。今回は様々な認知症の原因となる『Tauopathy(タウオパチー)』という疾患概念についてお話しします。
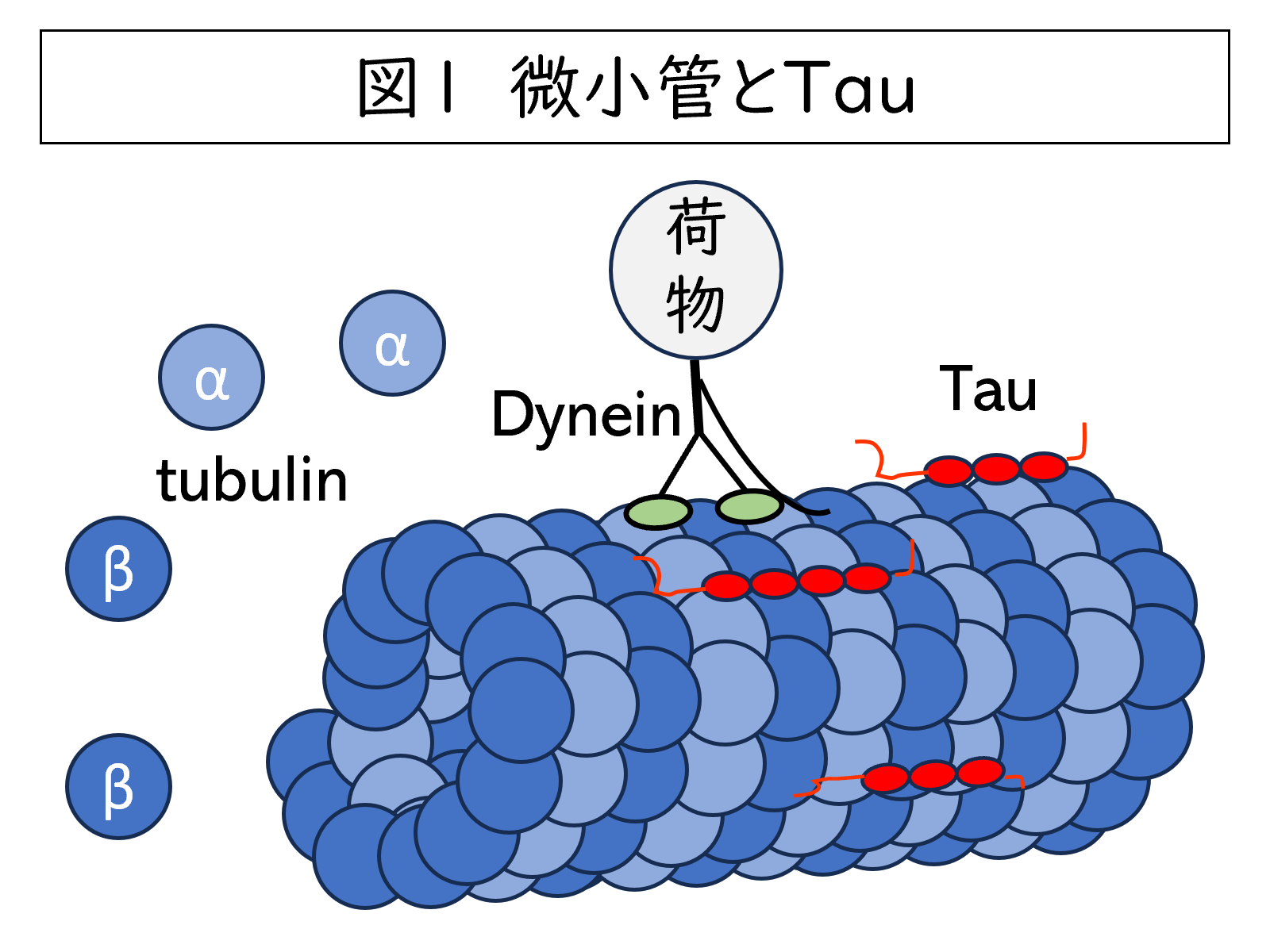
私たちの脳は大きく分けて神経細胞とグリア細胞の2種類の細胞から構成されています。神経細胞は長い突起を持ち、その突起を正常に維持するために様々な分子が働いています。今回のテーマであるTauタンパクは、中枢神経系の神経細胞に豊富に存在し、神経細胞突起を構成する細胞骨格結合タンパクの一つです。
神経細胞の細胞骨格には微小管、アクチンフィラメント、として中間系フィラメント(ニューロフィラメント)という3つの細胞骨格が存在します。Tauという名前の由来はギリシャ文字の τ(タウ)で、1975年にMarc Kirschnerらが微小管(tubule)形成を誘導できることから命名したことからわかるように、微小管に結合し安定化させる機能を有します。図1に微小管とTauのイメージ図を記しています。微小管はα-tubulinとβ-tubulin という2種類のtubulinが重合して形成される細胞骨格で、緑で示すようなDyneinなどの細胞輸送タンパクが移動するため細胞が正常に機能するために非常に重要な構造です。TauタンパクはmRNAからタンパク質が作られる際に、微小管結合領域(図の赤い丸)を3つ含む3-repeat (3R) Tauと、4つ含む4R Tauの2つの種類(isoform)が作られます。
神経変性疾患とは、脳や脊髄といった中枢神経系や、末梢神経系において、様々な要因で神経細胞やグリア細胞の機能や構造が変化し、最終的に脱落してしまう疾患の総称です。その中には、普通であれば分解されるタンパク質が分解されずに凝集し、細胞に悪影響を与える疾患が存在します。そのような凝集物は疾患を鑑別する際の証拠として非常に重要な所見です。例えば認知症の原因疾患として最も多いアルツハイマー病では、アミロイドβ(Aβ)と呼ばれるタンパクが大脳皮質に沈着するとともに、Tauタンパクが神経細胞の中に沈着し病理学的な診断根拠となります。血液検査や画像解析の技術が進歩した今でも、神経変性疾患の患者様の確定診断のためには、亡くなった後に病理解剖を行い、脳の病理検索が必要です。
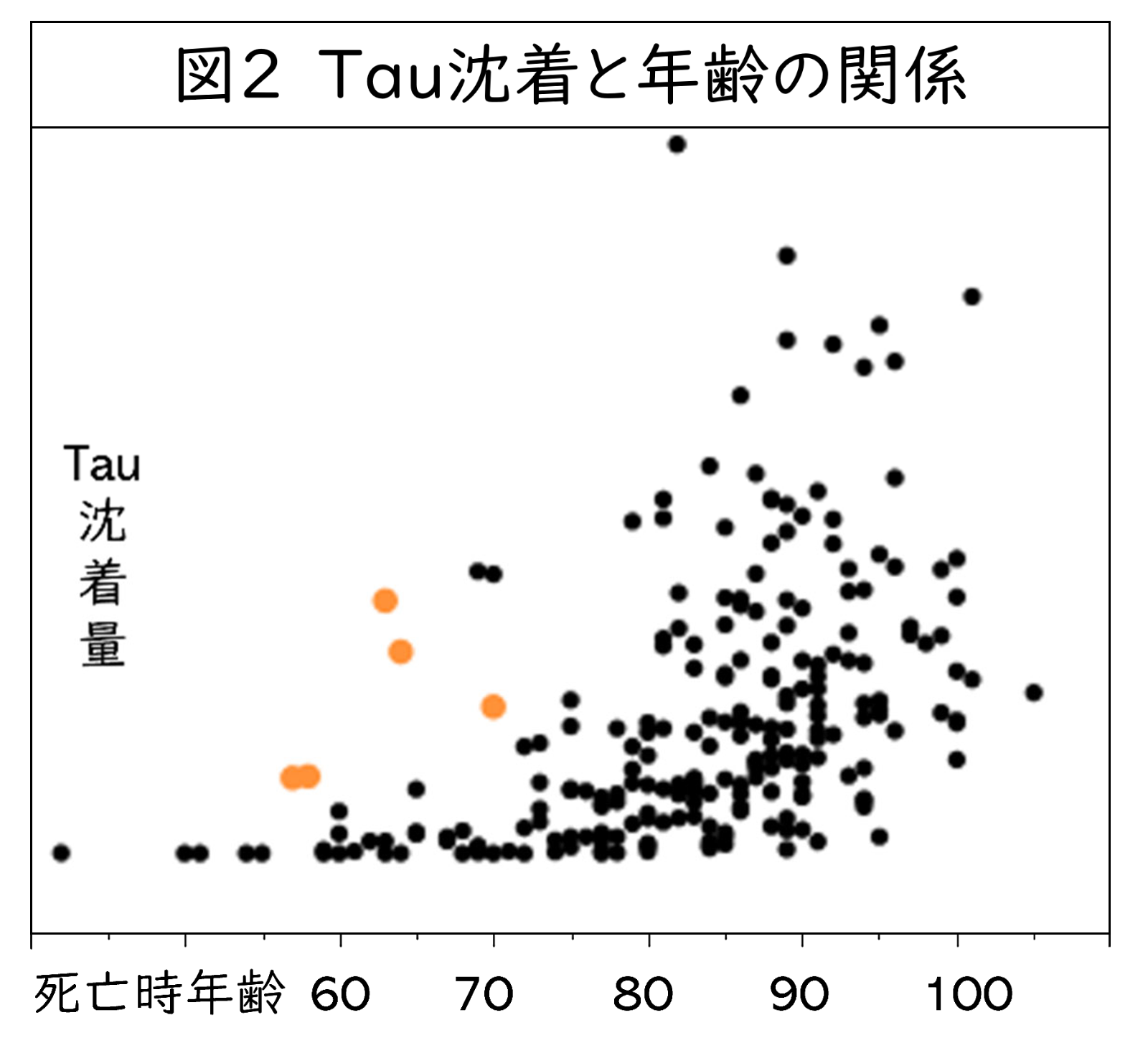
AβやTauタンパクの沈着は正常加齢でも起こり得ます。Tauタンパクは認知機能を司る海馬の周辺から沈着をはじめ、海馬本体へと沈着領域を広げます。図2に日本の一般住民の皆様の剖検脳海馬を対象にTau沈着量を検討した論文に、一部データを追加したものを示してしています1。縦軸に海馬のTau沈着量を、横軸に死亡時の年齢をとった図ですが、65歳以上218名中Tau沈着が全くなかった方は8名だけで、ほとんどの方に多少なりともTau沈着が見られます。Tau沈着が軽度であれば認知機能は保たれますが、より広範囲に広がり様々な機能を障害することでアルツハイマー病の発症につながります。このようなアルツハイマー病をはじめとしたTauタンパクが原因で起こる神経変性疾患を、疾患を意味する「-pathy」をつけてTauopathyと呼称します。
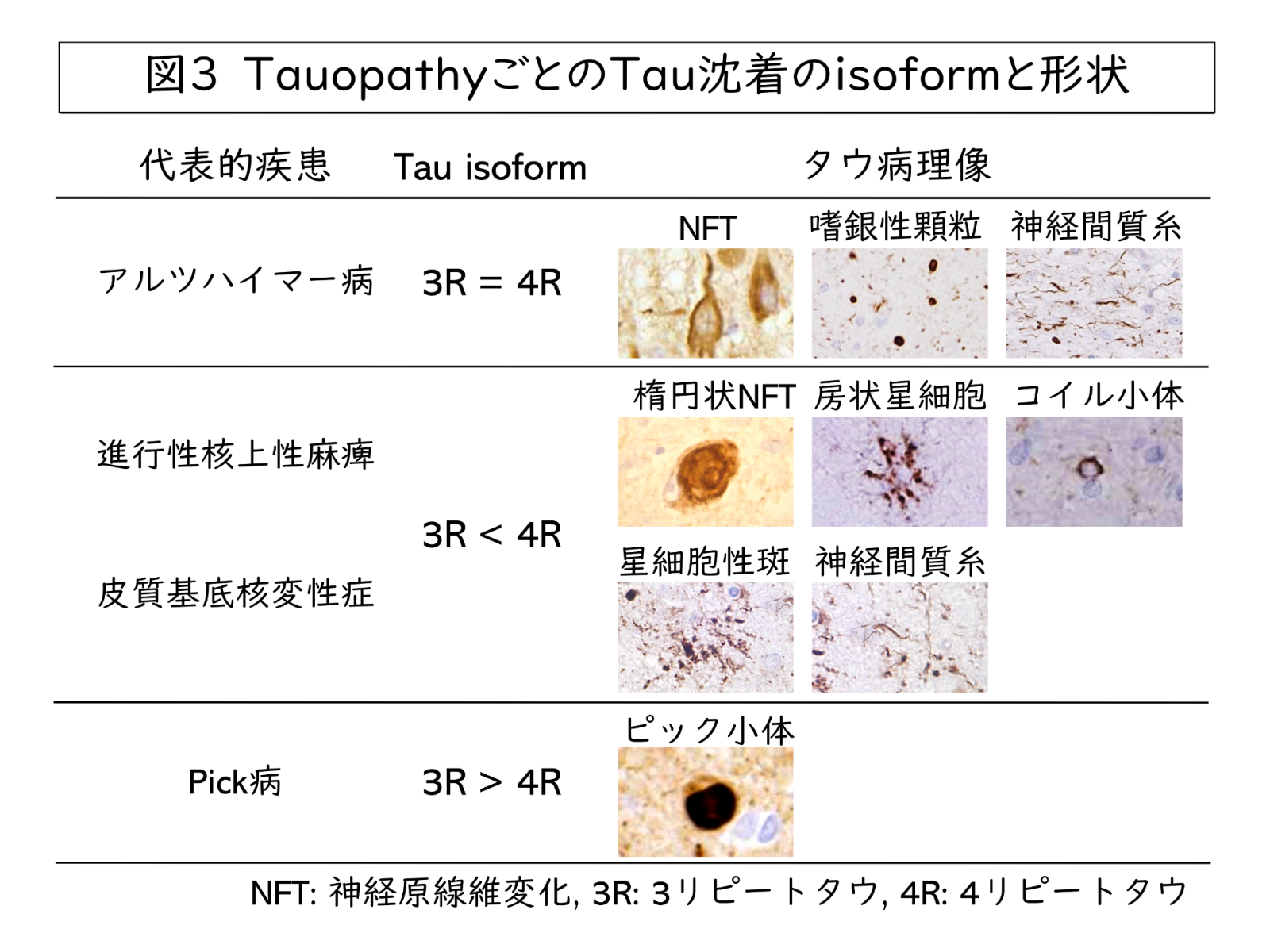
Tauopathyにはたくさんの疾患が含まれます。一部ですが代表的な疾患を図3にまとめました。疾患ごとに沈着するTauタンパクのisoformが異なり、また免疫組織化学という手法でTau沈着を可視化すると、非常に様々な形状の異常構造物が観察されます。
例えばアルツハイマー病では3R、4R両方のisoformが神経細胞内に沈着します。この構造物はTauタンパクが繊維状に重合し寄り集まってできたもので、神経原線維変化(Neurofibrillary tangle:NFT)、もしくはろうそくの炎のように見えることからFlame-shape NFTと呼ばれます。それ以外にも顆粒状の嗜銀顆粒や、線形の神経間質糸という構造物が見られます。一方で、進行性核上性麻痺という疾患では4R tau優位のTau沈着が見られます。形状もアルツハイマー病とは異なり、globose type NFTと呼ばれる円~楕円状の渦を巻くような構造物が神経細胞内にみられます。さらに神経細胞だけでなくグリア細胞の中にも、核近傍から突起を伸ばす房状星細胞と呼ばれる疾患特異的な沈着や、核を取り巻くコイル小体と呼ばれる沈着も観察されます。同じ4R優位のTauopathyでも、皮質基底核変性症は線形の神経間質糸に加えグリア細胞に星細胞性斑が出現します。一見すると先ほどの房状星細胞と同じように見えますが、核から少し離れてTau沈着が見られるのが星細胞性斑の特徴です。一方で3R tau有意に沈着するTauopathyではPick病という疾患が最も有名で、神経細胞内に球状のTau沈着が見られるのが特徴とされています。
このように、疾患によりTauタンパクのたまりやすい細胞の種類やTauのisoformが異なり、また同じ細胞の中の沈着でも炎状であったり球状であったりと、その形は多様性に富んでいます。今回は割愛しますが、それぞれの病変ごとに診断基準があり、病変の程度や広がりを基に診断を行います。
-早老病変と3R tauopathy-
次に、筋強直性ジストロフィー1型という遺伝性筋疾患のTauopathyとしての側面を、以前まとめたものにデータに追加してお話しします2。この疾患はDMPK1という遺伝子の反復配列が異常に伸長することが原因とされています。反復配列伸長によりRNAの凝集体が形成し、RNAに結合するタンパク質まで巻き込まれ、正常の機能を喪失することが機序とされています。筋肉をはじめとして全身性に症状を示しますが、加齢で見られる病気が若くして見られることが多く、早老症としての側面も知られています。またRNA結合タンパクの中にTauタンパクに関連しているものがあり、Tauのisoform として3R tauが増加します。驚くべきことに、脳病変では早老症としての側面と3R tauopathyとしての側面の双方が独立して観察されます。
まず早老症としての側面ですが、本疾患の特徴として、若年でありながら海馬領域で強いTau沈着が見られます。前の図に戻り申し訳ないのですが、図2には一般住民のデータに筋強直性ジストロフィーの方の海馬のTau沈着のデータを追加しオレンジ色で示しています。同年代である60~70歳前半の方と比べて非常に多くのTau沈着が見られます。このTau沈着は3R tau、4R tau共に陽性で、加齢性の変化が早期に起こっていると考えられます。
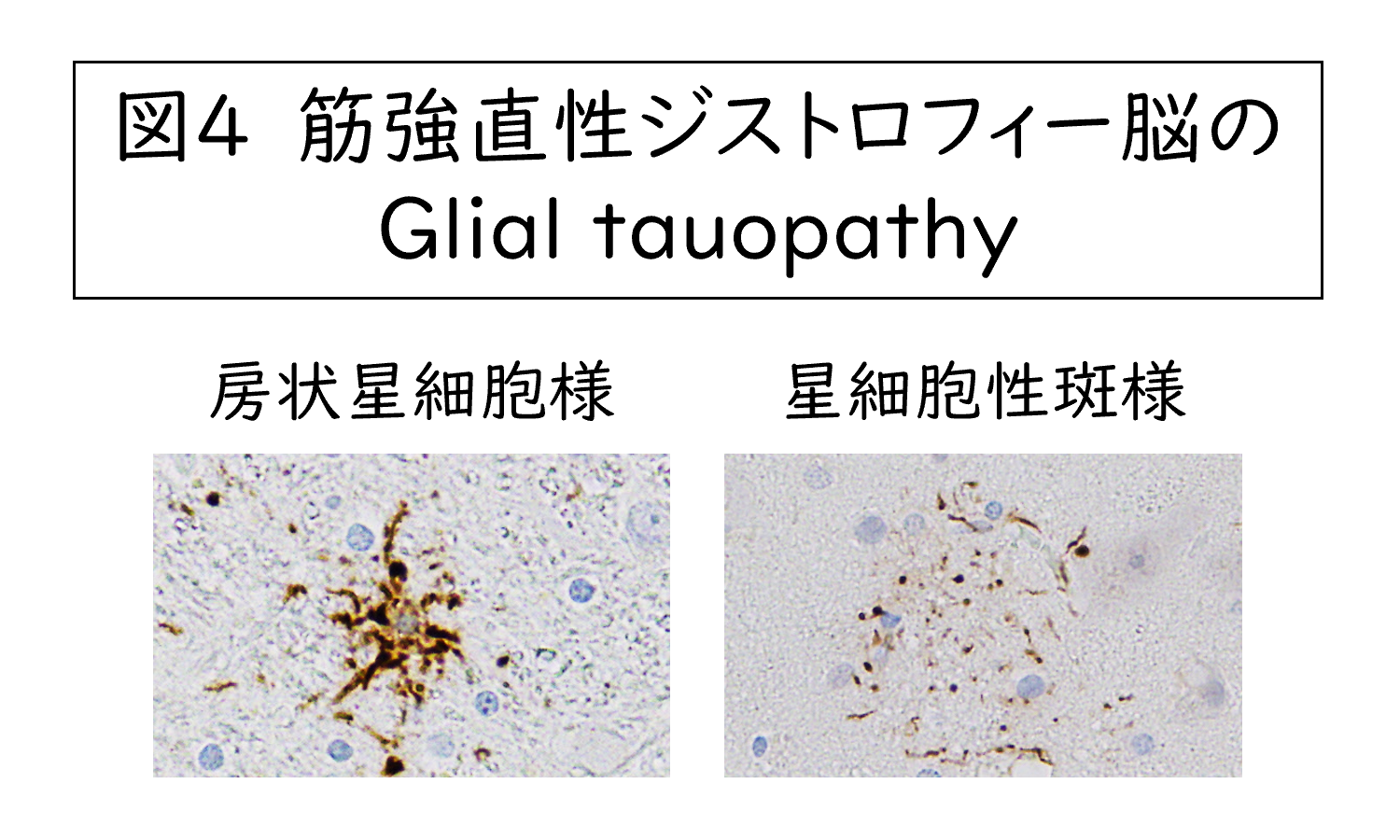
次に3R tauopathyの側面ですが、中脳や脳幹といった領域では、図4に示すように、通常加齢では見られないグリア細胞内のTau沈着が見られます。形としては房状もしくは斑状の星細胞のように見えますが、この病変は3R tauのみ染色され4Rは染色されないことから、3R tauopathyとしての病変が中脳、脳幹領域を中心に出現します。このグリア細胞の病変は海馬付近には出現せず、場所による違いが明確です。長らく星細胞は単一の細胞種と考えられていたのですが、近年、脳の部位や構造によって多様な遺伝子発現をすることが報告されており、そのような部位ごとの遺伝学的な多様性が背景にあるのではないかと考えています。
-微細な形を明らかにした新技術-
さて、ではなぜこのような様々な形態が見られるのでしょうか。近年、クライオ電子顕微鏡(Cryo-EM)という手技により、より微細な構造が原因ではないかという研究を行っているグループがあります。今回は概要だけお話ししますがCryo-EMは1974年に報告され、2017年にノーベル化学賞を受賞した技術です。2010年代に顕微鏡やレンズといったハードウェア面、解析ソフトウェア面の発展したことで生体材料でも実用化されました。2017年にNatureに報告された論文を皮切りに、NFTを形成するTauのコアとなる構造があり3、Tauopathyごとにコアとなる微細構造が異なる形状をしていることが報告され4、また微細構造を認識しTau沈着を抑制する化合物の開発といった治療へのアプローチも行われています5。
アルツハイマー病は発見されて100年以上経ちますが未だ根治する方法がありません。これは他のTauopathyに関しても同様です。その一方で、新たな切り口による治療法の開発が、今まさに進みつつあります。このような発展には実際のヒトの脳で起こっている出来事を明らかにすることが肝要であり、神経病学が担う重要な役割の一つです。これまで医学の発展のために病理解剖に御献体いただいた患者様、ご遺族の皆様の御遺志に改めて心よりの感謝を申し上げ、結びの言葉とさせていただきます。
引用
- Hamasaki H, et al. J Alzheimers Dis. 2017;55(2):613-624. doi: 10.3233/JAD-160521.
- Hamasaki H, et al.. J Neuropathol Exp Neurol. 2022; 9;82(1):29-37. doi: 10.1093/jnen/nlac097.
- Anthony W P Fitzpatrick, et al. Nature. 2017;13;547(7662):185-190. doi: 10.1038/nature23002.
- Sjors Hw Scheres, et al. Curr Opin Struct Biol. 2020;64:17-25. doi: 10.1016/j.sbi.2020.05.011.
- Sarah L Griner, et al. Nat Chem. 2019; 15:8:e46924. doi: 10.7554/eLife.46924.





