(2024年1月22日公開)
担当:武井延之先生
所属:腫瘍病態学分野
哺乳類は恒温動物であり、外気温が低くなっても体内で熱産生を行い生涯を通じて深部体温(体表では無く体の内部の温度)を一定の40度前後に保っています。ヒトの場合はこれが35度以下になると「低体温症」と言われる状態になります。話はちょっとそれますが、低体温症は怖い状態です。熱中症で亡くなる方のニュースを聞かれることも多いかと思いますが、実は低体温症で亡くなる方のほうが多い(厚労省調査2013−2022)ことをご存知でしょうか?また、そのうちの7割は、雪山や冬の海といった極端な環境ではなく、室内で亡くなっているのです。寒い室内で気を失ったり、怪我で動けなくなったりすると危険です。ちなみにWHOは低体温症を防ぐため、室内温度を18度以上とすることを勧告しています。低体温症は、深部体温が35−32度で軽度(長時間の身震いなど)、32−28度で中程度(意識の混濁など)、28度以下で高度(意識不明、身体硬直など)と定義されており、高度では命の危険がかなり高くなります。
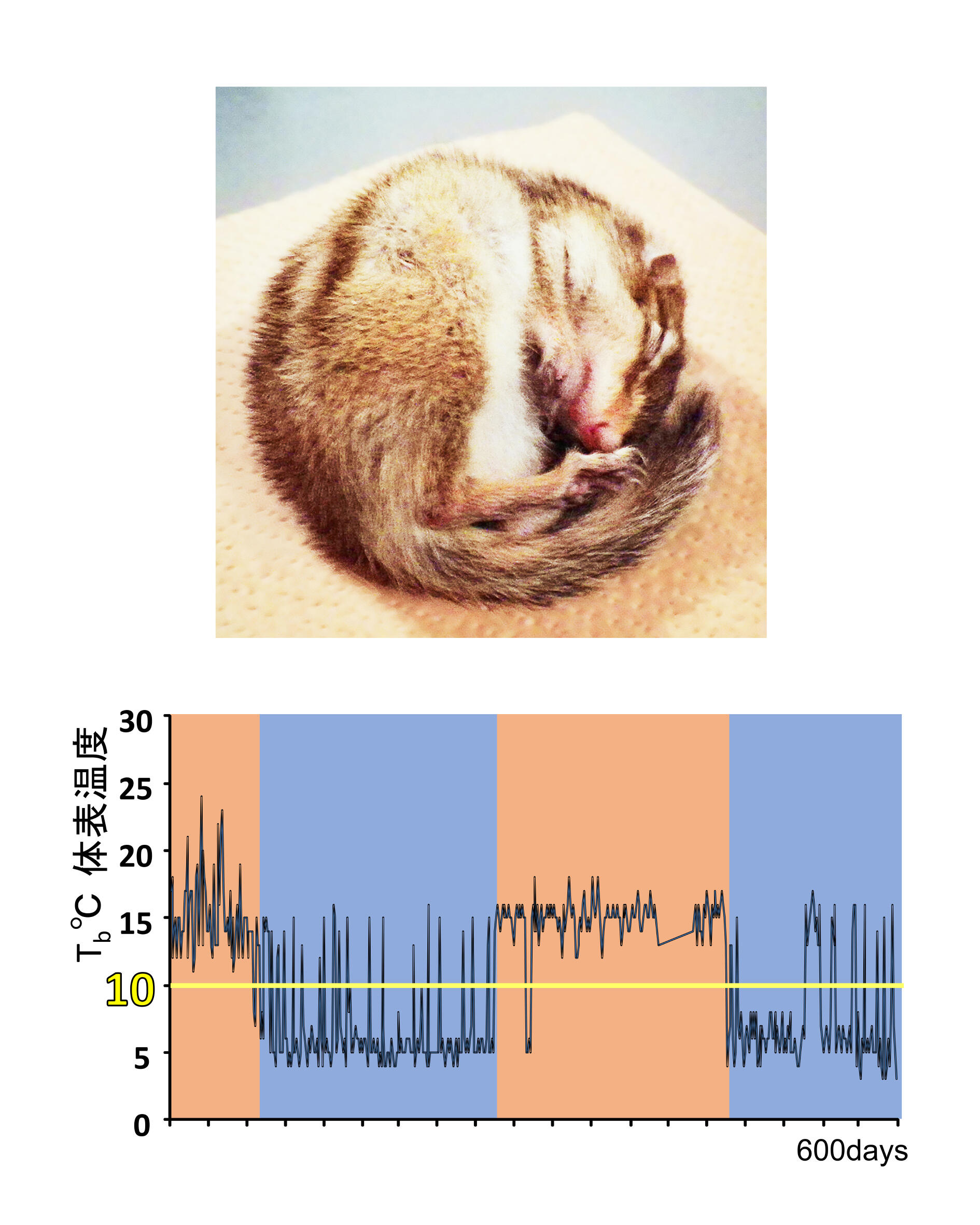
このように、私達ヒトを含むほとんどの哺乳類は低体温には耐えられません。ただし、例外があります。それが冬眠動物です。冬眠は、極寒の環境や飢餓などの過酷な状況を生き抜くための重要な適応と考えられていますが、同じような環境で暮らしていても冬眠しない動物もいます。哺乳類の冬眠のメカニズムはほとんどわかっていないと言ってもいいでしょう。研究が進んでいないのは、冬眠動物がラットやマウスなどの実験動物ではなく、野生動物が主であることや、年周期の現象であるため研究に時間がかかることもあります(図1に実験室(低温室)で飼育したシマリスの体表温度の変化の周期を示します。図では600日間記録しています)。また冬眠は動物個体のシステムとしての現象で、全体像を理解するためには個体を用いた研究が不可欠であることも、分子や細胞レベルでの研究を難しくしている原因です。また冬眠といってもクマなどでは体温は数度下がるだけですが、シマリスなどでは冬眠中は体表体温を4℃ほどまで下げ、触ると冷たく感じるほどです(さすがに深部体温0度以下になる哺乳類はいません)。心拍数も1分間に1回程度になります。ですから、細胞レベルでの低温耐性は異なっていると考えられます。
シマリスの体表温度変化のサイクル(下段)
冬眠がどのようにして始まるのか、冬眠の引き金は何なのかは謎でした。大きな進展はシマリスの冬眠蛋白の発見です(1)。冬眠タンパク質は肝臓で生成され、脳に移行して作用し、冬眠を誘発するとされています(図2)。さらに直接的な証拠として、非冬眠動物であるマウスの特定の神経細胞/回路の活動を操作すると、体温の低下など冬眠に似た状態(Toper:休眠)を引き起こすことが報告されています(2,3)。これらのことは冬眠が脳で引き起こされる可能性を強く示唆しています。
冬眠と代謝は深い関係がありますが、冬眠して体温が下がったために代謝が低下するのか、代謝が低下したために体温が下がり冬眠に入るのかは、実ははっきりしていません。
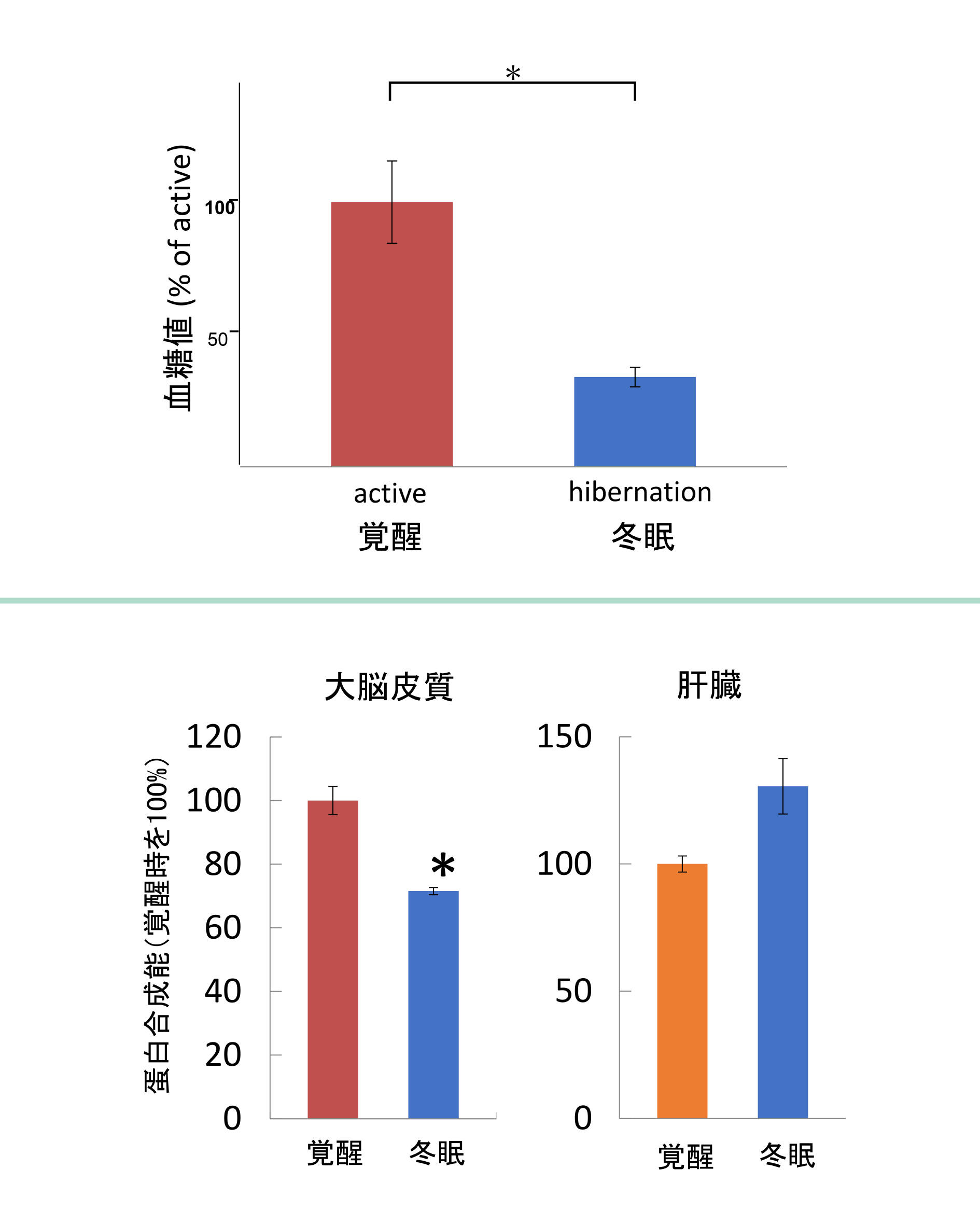
私達は冬眠研究の専門家ではありませんが、脳、特に神経細胞での代謝に興味を持っています。そこで、シマリスの脳と末梢組織におけるエネルギー感知シグナル伝達とタンパク質合成(主要な同化代謝経路)を比較しました。まず細胞内エネルギーセンサーであるAMPK(AMP活性化プロテインキナーゼ)と言う酵素に注目しました。このタンパク質リン酸化酵素は、グルコース欠乏などによる、細胞内のエネルギー通貨であるATPの不足を感知し、活性化します。そして細胞の活動・成長の司令塔とも言えるラパマイシン標的蛋白(mTOR:mammalian target of rapamycin)(4)を抑制します。その結果、オートファジーなど異化(分解)経路を促進し、細胞に蓄えられた分子をエネルギーに変換していき、同時に脂肪酸合成、糖新生、タンパク質合成などの同化(合成)経路を抑制します。つまり全体的に代謝を落とす方向に働きます。冬眠中のシマリスでは血糖(グルコース)値が半分以下に低下しましたが(図3上段)、AMPK活性は脳(大脳皮質)のみで上昇し、肝臓と骨格筋では上昇しませんでした。AMPKの基質であるアセチル-CoAカルボキシラーゼのリン酸化も冬眠中の脳でのみ亢進しており、不活性化を示すとともに脂肪酸合成の抑制を示唆しました。同時に、冬眠脳ではmTORと翻訳因子である(eEF2)の活性が低下しており、冬眠脳におけるタンパク質合成の低下が示唆され、実際、冬眠中の脳組織では、活動中のシマリスよりもタンパク質合成能が低いこともわかりました。しかし肝臓のタンパク質合成率は活動期シマリスと冬眠期シマリスで差がありませんでした(図3下段)。これらの結果は、冬眠に伴う代謝ダウンレギュレーションが、少なくとも冬眠初期には脳で起こっていることを示しています(4)。
蛋白合成能(下段)の変化。(文献5より)
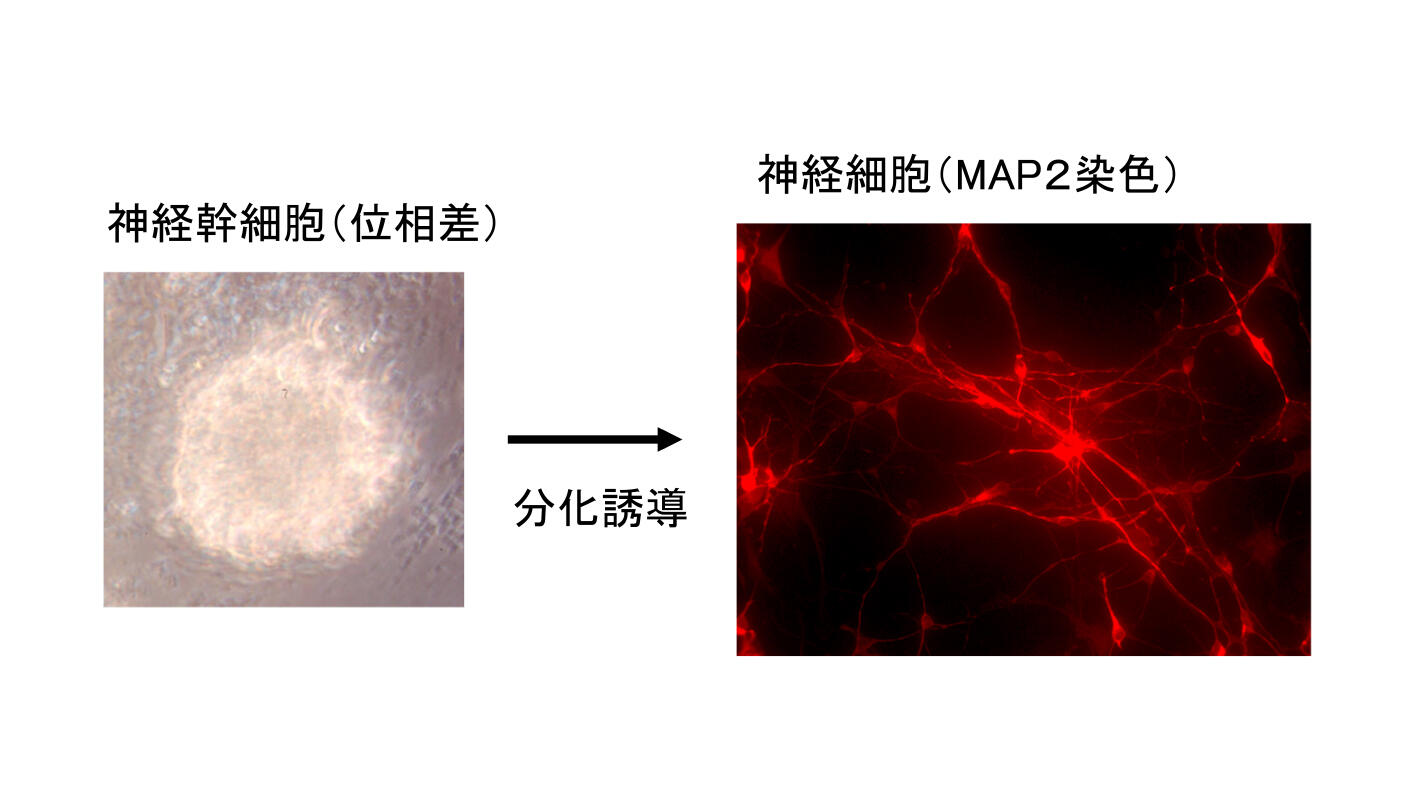
冬眠蛋白はアディポネクチンを含むC1qファミリーのメンバーであり、アディポネクチンはAMPKのリン酸化(=活性化)を誘導することが知られています。ここからは仮説ですが、1)冬眠タンパク質が年周期のリズムで脳に浸透する。→2)冬眠タンパク質が未知の受容体を介してAMPKを活性化し、代謝を抑制する。→3) 神経細胞が低温耐性を獲得して、体全体の代謝の制御を行う。ということを考えています。冬眠蛋白の直接作用や低温耐性は細胞レベルで検討する必要があります。現在シマリスの神経細胞の初代培養系を確立しましたが、シマリスは実験室での繁殖が難しく通年で実験することが困難です。そこで神経幹細胞の凍結保存を行い、必要時に培養下で分化させ、神経細胞の培養ができるようにしました(図4)。シマリスの神経細胞の低温耐性が冬眠蛋白の有無で変わるか?またその時細胞内ではどのようなシグナル伝達が起きているのかを明らかにすれば、ヒトの細胞での再現も可能になるかもしれません。まだまだ長い道のりが必要ですが、いくつもの研究を組み合わせ、冬眠研究の全体像が明らかにされればと願っています。
冬眠の謎が解明されれば、救急時や移植時の臓器保護など、臨床の現場でも応用可能な技術の開発につながります。またSF小説でよく描かれる人間の「コールドスリープ(冷凍睡眠)」にも応用できるかもしれないというロマンもあります。何に役立つか、皆さんも考えてみてください。
参考文献
- Kondo N et al. (2006) Circannual control of hibernation by HP complex in the brain. 125:161-72. doi:10.1016/j.cell.2006.03.017.PMID:16615897
- Hrvatin S et al. (2020) Neurons that regulate mouse torpor Nature 2020 Jul;583(7814):115-121. doi:10.1038/s41586-020-2387-5.
- Takahashi TM et al. (2020) A discrete neuronal circuit induces a hibernation-like state in rodents Nature 2020 Jul;583(7814):109-114. doi:10.1038/s41586-020-2163-6. Epub 2020 Jun 11.
- Takei N and Nawa H (2014) mTOR signaling and its roles in normal and abnormal brain development. Front Mol Neurosci. 7:28. doi:10.3389/fnmol.2014.00028. eCollection 2014.
- Yamada S et al. (2019) AMPK activation, eEF2 inactivation, and reduced protein synthesis in the cerebral cortex of hibernating chipmunks Sci Rep 2019 Aug 15;9(1):11904. doi:10.1038/s41598-019-48172-7.