(2023年11月1日公開)
担当:小池佑佳助教
所属:分子神経疾患資源解析学分野
神経変性疾患は、加齢とともに発症リスクが高まるため、高齢化社会において、その制御は重要な課題である。病気と関連し、加齢を規定する因子の一つとして、「エピジェネティクス」がある。エピジェネティクスとは、アデニン(A)・チミン(T)・グアニン(G)・シトシン(C)からなる塩基配列自体には変化がないまま、長期にわたって、遺伝子発現のオン・オフが変わる現象のことであり、細胞の種類ごとにオンになる遺伝子の組み合わせが異なることで、細胞の多様性を生み出している。エピジェネティクスは、遺伝子の塩基配列だけが生物の特性を決めるわけではない、ということを示している。ここでは、エピジェネティクスの一つである、「DNAのメチル化」と神経変性疾患の一つである、筋萎縮性側索硬化症 (ALS) の関連について概説する。
DNAのメチル化修飾とは全ての細胞が、同じ塩基配列からなる遺伝情報を有しているのに、各臓器や筋肉、神経、血管など別々の機能をもつ細胞になるのは、実際に発現させる遺伝子と発現させない遺伝子に目印をつけているからである。この目印の一つが「DNAのメチル化」である。DNAメチル化は、4つの塩基のうち、シトシン (C) の炭素原子に、メチル基「Cspan」が付加される現象のことを指す。このメチル化によりゲノムの構造や機能が変化し、遺伝子の発現に影響を及ぼす。例えば、遺伝情報が同じ一卵性双生児であっても、寿命に大きな違いがあることや、中年期以降の生活習慣病や癌に対する感受性が異なることが知られる。それは遺伝子のヌクレオチド配列の違いでは説明できない。しかし、DNAメチル化のような、エピジェネティックな違いは、その説明を可能にした。DNAのメチル化は、以前から、がんや発達の領域で、遺伝子の発現を調節する仕組みとして研究が進められてきた。また、加齢の仕組みそのものに、DNAのメチル化が関連することが注目されている1。さらに興味深いことに、DNAのメチル化状態が規定する「エピジェネテッィク年齢」は、実年齢より、ヒトや動物の生物学的な加齢を反映し、加齢性疾患の発症とも関連する2。
DNAのメチル化と筋萎縮性側索硬化症筋萎縮性側索硬化症 (ALS)は、主に50歳代以降に発症し、運動神経細胞が慢性進行性に変性する病気である。そして、家族歴のないALS患者さんにおいて、発症の最大のリスクは加齢である。さらに、DNAのメチル化状態で規定されるエピジェネティック年齢は、孤発性ALSの発症年齢や生存期間と関連する3。しかし、DNAメチル化が、どのようにALSの発症と関連するのか、そのメカニズムは不明であった。
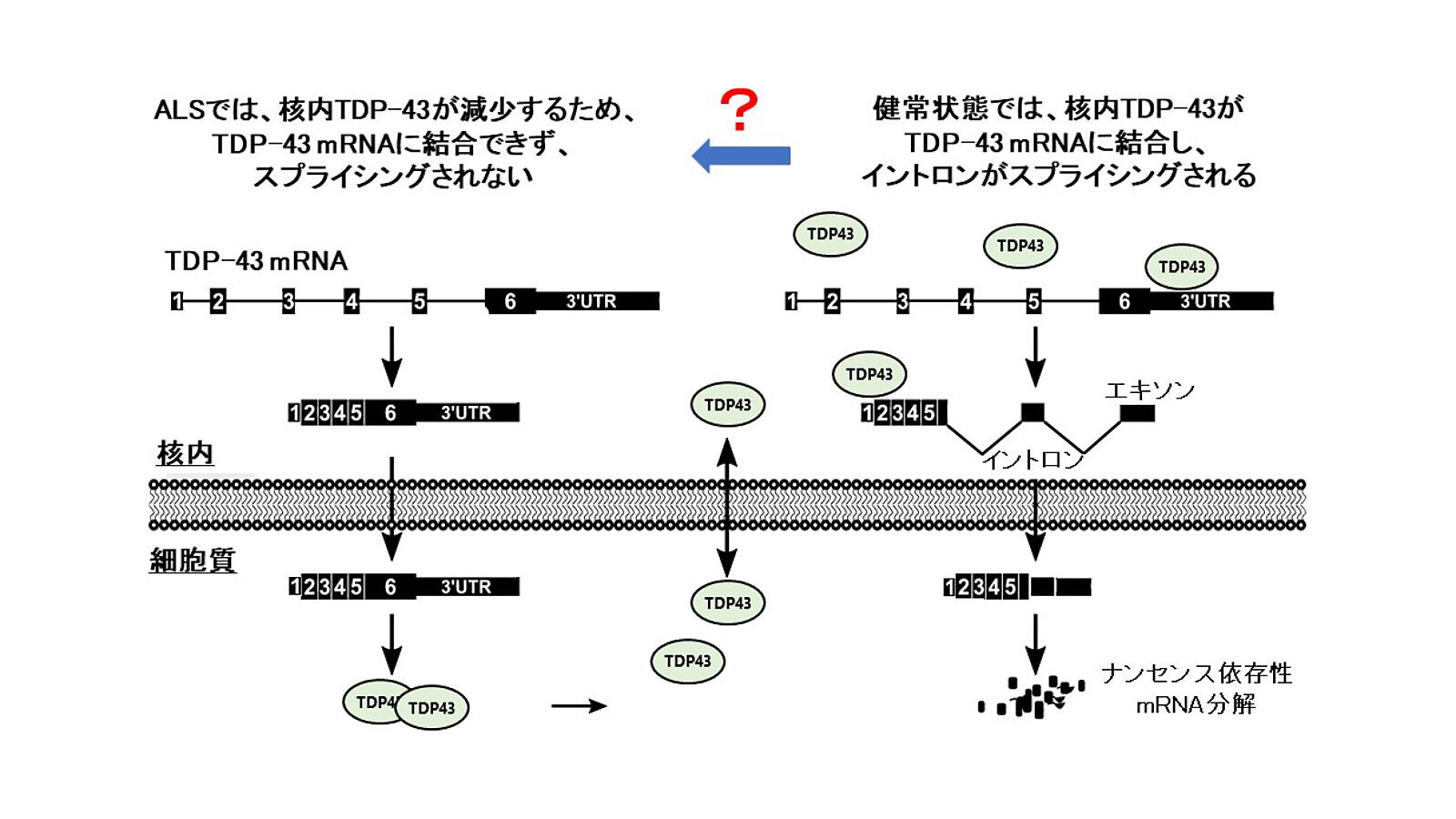
ALSの病態には、TAR DNA-binding protein 43 (TDP-43)という蛋白が重要な役割を果たす。このTDP-43は、正常では、核内で生体に重要な様々な機能を担う蛋白である。しかし、ALS患者さんの運動神経細胞では、病気の早期より、TDP-43が核から消失し、細胞質に凝集する。このTDP-43の、核における本来の機能の一つとして、自分自身や他の遺伝子のRNAの「スプライシング」を制御する。
私達の研究室では、これまでに、TDP-43が、核内で、自分自身の蛋白合成の元となる、RNAの前駆体 (TDP-43 mRNA)におけるスプライシングをコントロールして、TDP-43の量を自己調節することを見出した4。そして、この現象を、マウスモデルやiPS由来運動神経で検証してきた5。細胞内のTDP-43の量は、多くても少なくても、病的な状態に繋がるため、この「自己調節機構」が存在すると考えられる。さらに、ALS患者さんの運動神経細胞では、このスプライシングを介したTDP-43量の自己調節機構が乱れていることを明らかにした4。しかし、なぜALSで、このスプライシングを介した、TDP-43の自己調節機構が乱れるのか、大きな謎であった。(図1)
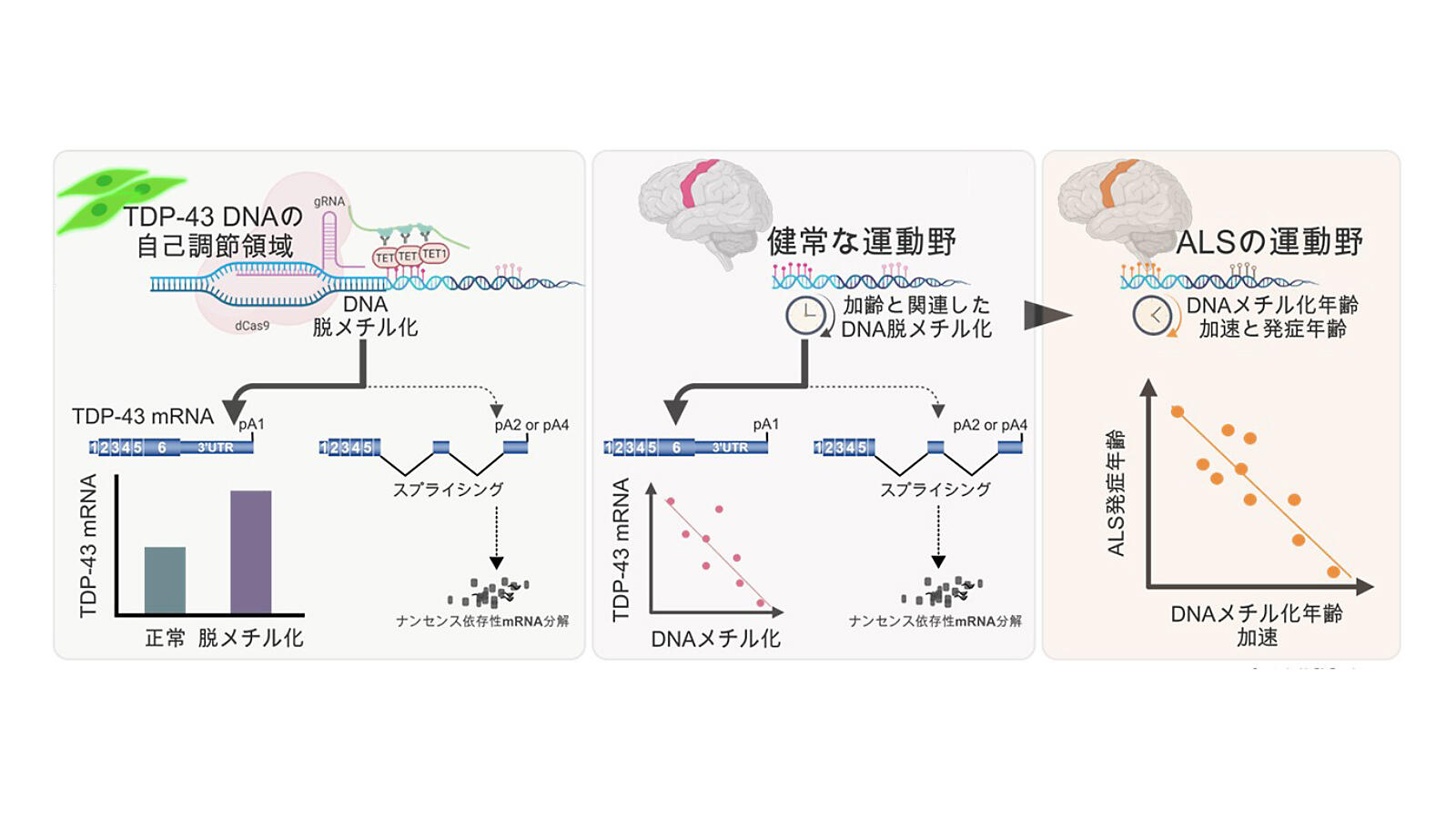
そのような中、私たちは、スプライシングを調節する因子の一つとして、DNAのメチル化があること6、TDP-43の自己調節領域がメチル化されうるシトシン塩基に富むことから7、加齢による脱メチル化が、TDP-43の量の自己調節機構を攪乱すると考えた。そして検証の結果、ALSによって選択的に障害される部位であり、ヒトの運動機能を司る「運動野」においてのみ、1)加齢によりTDP-43の自己調節領域の脱メチル化が進行して、TDP-43量が増加すること、及び、2)ALS患者さんにおいては、TDP-43の自己調節領域のメチル化状態が、ALSの発症年齢と関連することがわかった7。これにより、DNAメチル化は、加齢と関連して、ALS病態に寄与することが明らかになった。(図2)
これまでの研究では、ALS患者さんと健常の方の脳を明確に区別できるような、DNAメチル化の変化はまだ見出せていない。また、そのメチル化とALS病態の繋がりの本態にも十分に迫れていない。それらの謎を解決していくためには、従来組織レベルで解析していた、DNAメチル化やスプライシング制御に関して、一細胞レベルで、詳細に解析する方法を確立していく必要がある。
参考文献
- Benayoun BA, et al. Epigenetic regulation of ageing: linking environmental inputs to genomic stability. Nat Rev Mol Cell Biol 2015; 16 (10): 593-610.
- Horvath, et al. DNA methylation-based biomarkers and the epigenetic clock theory of ageing. Nat Rev Genet 2018; 16 (10): 593-610.
- Zhang, et al. DNA methylation age acceleration is associated with ALS age of onset and survival. Acta Neuropathol 2020; 139 (5): 943-946.
- Koyama, et al. Increased cytoplasmic TARDBP mRNA in affected spinal motor neurons in ALS caused by abnormal autoregulation of TDP-43. Nucleic Acids Res 2016; 44 (12): 5820-5836.
- Sugai, et al. Non-genetically modified models exhibit TARDBP mRNA increase due to perturbed TDP-43 autoregulation. Neurobiol Dis, 2019; 130: 104534.
- Shukla, et al. CTCF-promoted RNA polymerase II pausing links DNA methylation to splicing. Nature 2011; 479 (7371), 74-79.
- Koike Y, et al. Age-related demethylation of the TDP-43 autoregulatory region in the human motor cortex. Commun Biol, 2021; 4(1): 1107.