2023年9月25日公開
担当:内ヶ島基政先生
所属:細胞病態学分野
「抗体」と聞いて皆さんは何を思い浮かべるだろうか。少なくとも脳を思い浮かべる人は少ないに違いない。事実、2019年から続く新型コロナウイルスによるパンデミック以来、連日メディアを通じて耳にしてきたように、抗体は、私達にとって異物である細菌やウイルスから身体を守るための免疫系と呼ばれる生体防御システムの一部を担っている。しかし、脳研究所の研究者や臨床医が研究と診療を進める上でも、抗体は欠くことのできない重要なツールである。本稿では、抗体と脳の研究・臨床とのかかわりを紹介したい。
1. 抗体とは?抗体は、リンパ球の1つであるB細胞が産生する巨大な糖タンパク質であり、免疫グロブリン(Ig)とも呼ばれる。1個の抗体分子は、1本のアミノ酸鎖からできているのではなく、重鎖と軽鎖と呼ばれるアミノ酸鎖が2本ずつジスルフィド結合を介して組み合わさってできるY字型構造を示す(図1)。Y字の上半分の二股部分に相当する2つのドメインをFab領域、下半分の1本の棒状部分をFc領域と呼ぶ。Fab領域は、先端側の可変領域とFc領域との連結側の定常領域に分けられる。可変領域のアミノ酸配列は、定常領域と比べて多様であり、様々な抗原エピトープ(抗原の一部)の特異的な認識を担う。一方、Fc領域は定常領域のみを持つ。この部位は、貪食細胞の細胞表面に発現するFc受容体によって認識され、抗原の貪食を媒介する。
抗体が抗原と結合すると、大きく3つの作用をもたらす。1つは、上記のFc領域を介した貪食細胞による食作用の亢進であり、残りは、補体の活性化と、抗原の細胞内への侵入を防ぐ中和である。いずれも体内に侵入した細菌やウイルス、さらには毒素から身体を守るために重要な役割を果たす。
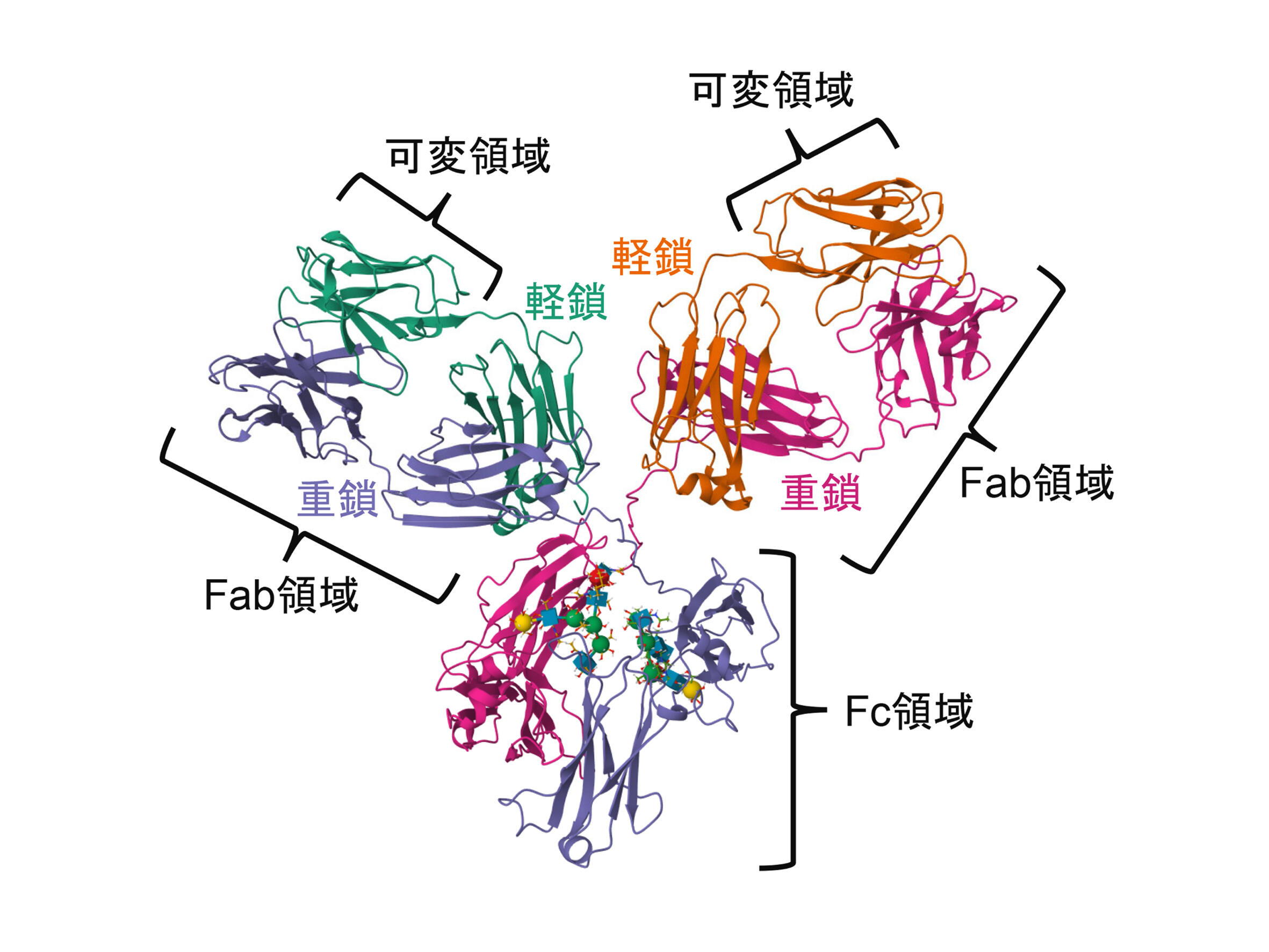
図1:抗体分子の立体構造(PDB:1IGY)
私達の外界には、細菌やウイルス、毒素などの抗原が無数に存在する。抗体は、可変領域の多様性を通じて、それらを識別できる。しかし、私達の限られたゲノムの中に異なる可変領域の1つ1つをコードした遺伝子領域はない。では、抗体の遺伝子はどのようにして多様な可変領域を実現しているのであろうか?この問いに対する1つの答えを出したのは、1987年にノーベル生理学医学賞を受賞した利根川進博士である。利根川博士は、可変領域をコードする抗体遺伝子が多数の遺伝子断片から成り立っており、この遺伝子断片のいくつかがB細胞の成熟の過程で再構成されることで、可変領域に多様性をもたらすことを発見した1。その後、体細胞超変異をはじめとする、抗体の多様性を高める仕組みが明らかにされ、ヒトは100京種類もの異なる抗体を産生可能であることがわかっている2。
3. 分子標識ツールとしての抗体あらゆる生体分子を識別する抗体の性質は、脳をはじめとする生命科学研究に役立つ。タンパク質をはじめとする様々な生体分子によって構成される生体内で起きていることを分子レベルで理解するためには、どの生体分子がどこに分布しているのかを正確に知る必要がある。しかし、分子が色付けされていたり、光ったりすることはないので、このままではどこに何があるかはわからない。ここで抗体の出番である。私達のワクチン接種のように、対象分子の一部あるいは全体を抗原として動物に免疫することで、対象分子を特異的に認識する抗体を人為的に作り出すことができる。こうして得られた抗体と組織を免疫反応させると、組織中の対象分子を探し出すことが可能になる。
4. 抗体を用いた脳研究脳を知る上で、分子局在の理解が最も重要なものの1つがシナプスである。シナプスは、ニューロン同士の神経回路のつなぎ目に作られる1ミクロン(1,000分の1ミリメートル)に満たない非常に小さな接着構造である。シナプスを挟んで一方のニューロンから神経伝達物質が放出され、もう一方のニューロンがそれを受け取ることによって情報伝達が行われる。私達の脳内には1000兆個ものシナプスが存在し、多彩な情報伝達を行う。例えば、シナプスの情報伝達強度は、学習や記憶、経験に応じてシナプスごとに異なる変化を示す。したがって、脳内における情報処理過程を理解するためには、このようなシナプスの多様性を調べなければならない。この点で、抗体を用いた脳内シナプス分子のマッピングは、様々なシナプスの分子構成を効率的に可視化できる理想的な手段である。しかし、抗体によるシナプス分子の検出は必ずしも容易でない。その最大の理由は、シナプスが多数の分子を含む高密度構造であるが故、巨大な抗体分子がシナプス内部に埋め込まれた分子に十分アクセスできないからである。
私達は、シナプスの密な構造を解きほぐす、あるいは薄くスライスすることによって、シナプス分子を物理的に露出させ、抗体分子がシナプス分子にアクセスできるよう工夫を行ってきた3-5。これにより、例えば、報酬に関わるドーパミンを神経伝達物質とするドーパミン作動性シナプスは、ドーパミン受容体の集積を伴わずに、ドーパミンの放出部を標的構造に括りつけているユニークなシナプスであることを世界で初めて示すことができた(図2)4。また、学習記憶において重要な海馬において、GABA作動性シナプスの一部が、自閉症関連シナプス接着分子Nlgn3を発現することも解明した5。この結果は、自閉症が脳内全てのシナプスの異常に基づくものでなく、一部のシナプスの異常に起因しているのではないかという仮説を支持するものである6。このように、分子特異的な抗体は、免疫反応を介したシナプス分子発現局在解析を通じて、正常あるいは疾患における脳内情報処理のための基盤の理解に欠かせない存在となっている。
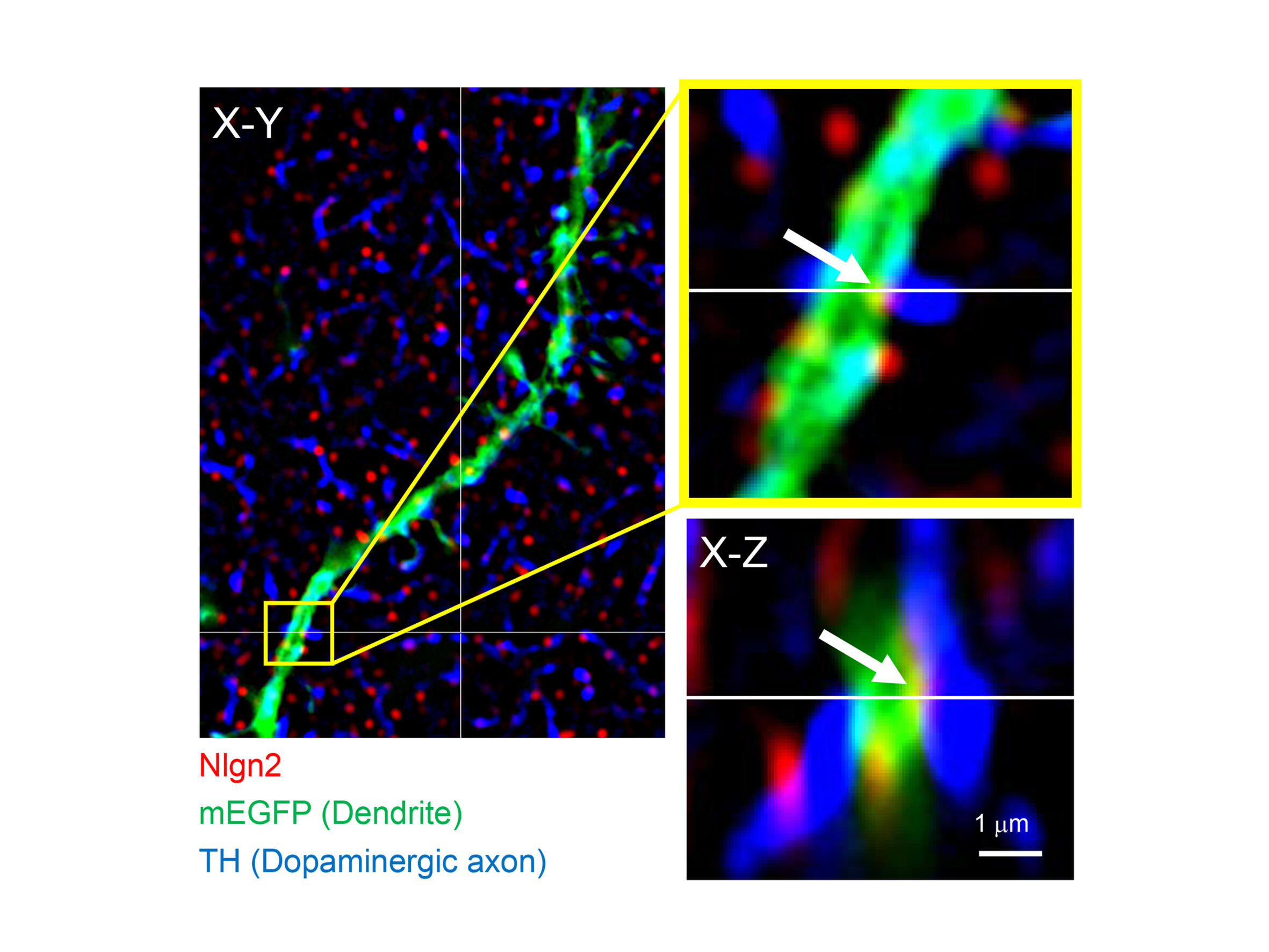
図2:マウス線条体ドーパミンシナプスの超解像顕微鏡像(3D-SIM)
シナプス接着分子ニューロリギン2(赤)、樹状突起(緑)、ドーパミン作動性軸索(青)に対する3重標識を行っている。矢印がドーパミンシナプスを示す。
分子標的ツールとしての抗体は、研究のみならず、臨床における脳神経疾患の病理診断および治療にも応用されている。例えば、グリア細胞の一種であるアストロサイトに発現するグリア線維性酸性タンパク質(GFAP)に対する抗体は、アストロサイト由来の脳腫瘍の病理診断に利用される。また、一昨年に話題となった本邦のエーザイ社らが開発中のアルツハイマー病新薬も実は抗体(アデュカヌマブ)である7。アルツハイマー病は、進行性の認知症を伴うニューロン変性疾患であり、未だ治療法が確立していない難病である。アルツハイマー病を患った脳内では、アミロイドβの凝集体の沈着が広く知られている。この病理所見から、アミロイドβの沈着がニューロン変性を引き起こす原因であり、それを取り除けばアルツハイマー病を治療できるというアミロイド仮説が提唱されてきた。この仮説に基づいた新薬であるアデュカヌマブは、アルツハイマー病に伴って蓄積したアミロイドβを免疫細胞を介して脳内から除去するための抗体である7。これまでに多くの製薬企業が類似の抗体医薬の臨床試験に失敗してきた中、アデュカヌマブは米国食品医薬品局(FDA)の条件付き承認を得ることができた。今後の進展に期待が寄せられる一方、得られた認知症改善効果はごくわずかであるため、アミロイド仮説の真偽も含めて依然として議論が残っている8。
おわりに本稿では、生体防御システムとしての抗体ではなく、医学生物学的ツールとしての抗体の有用性を紹介してきた。抗体は、あらゆる分子を識別できるという特性を持つが故、本来の生体防御システムの枠内を越えて、脳の研究から診断、治療への更なる応用が期待されている。一方、本稿では触れなかった技術的なハードルも存在する。抗体の作製は免疫動物に依存する部分が大きく、分子特異的な抗体を効率的に作製するための方法は未だ確立されていない。また、仮に、特異性の高い抗体が得られたとして、その抗体を大量かつ安価に作り出すための技術も不十分である。このような課題を克服できれば、分子標識ツールとしての抗体の重要性は、脳の研究や臨床のみならず、幅広い領域において今後ますます高まっていくものと思われる。
引用文献
- Hozumi and Tonegawa, Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. Proc Natl Acad Sci USA, 73(10): 3628-32, 1976
- Briney et al., Commonality despite exceptional diversity in the baseline human antibody repertoire. Nature, 566(7744): 393-97, 2019
- Watanabe et al., Selective scarcity of NMDA receptor channel subunits in the stratum lucidum (mossy fibre-recipient layer) of the mouse hippocampal CA3 subfield. Eur J Neurosci, 10(2): 478-87,1998
- Uchigashima et al., Dopamine synapse is a neuroligin-2-mediated contact between dopaminergic presynaptic and GABAergic postsynaptic structures. Proc Natl Acad Sci USA, 113(15):4206-11, 2016
- Uchigashima et al., Specific Neuroligin3-αNeurexin1 signaling regulates GABAergic synaptic function in mouse hippocampus. Elife, 9:e59545, 2020
- Uchigashima et al., Neuroligin-3: A Circuit-Specific Synapse Organizer That Shapes Normal Function and Autism Spectrum Disorder-Associated Dysfunction. Front Mol Neurosci, 14:749164, 2021
- Sevigny et al. The antibody aducanumab reduces Abeta plaques in Alzheimer's disease. Nature, 537(7618):50-56, 2016
- Karran and Strooper, The amyloid hypothesis in Alzheimer disease: new insights from new therapeutics. Nat Rev Drug Discov, 21(4):306-18, 2022





