(2023年3月23日公開)
担当:島田 斉 先生
所属:臨床機能脳神経学分野
はじめに
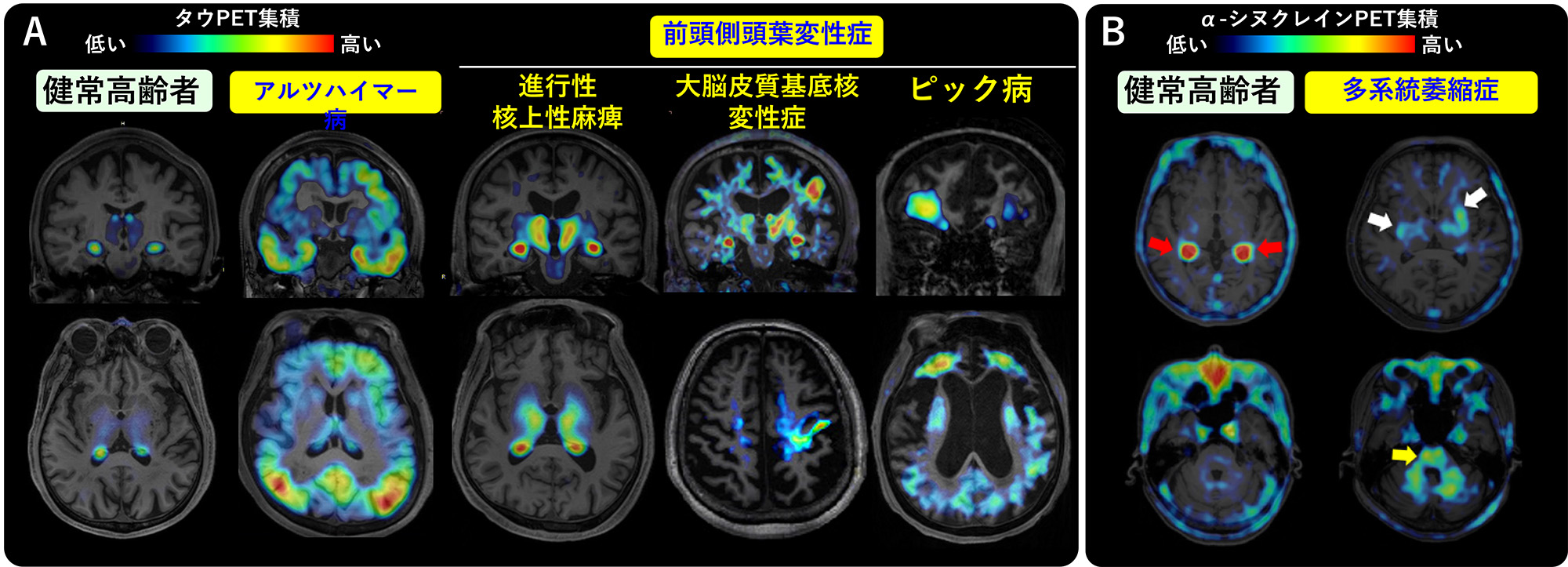
アルツハイマー病やパーキンソン病などに代表される神経変性疾患においては、脳の中にさまざまな異常たんぱくの蓄積が見られることが知られています。脳内に見られる異常たんぱくの蓄積は病期の発症に密接に関与していると考えられているため、診断上ならびに治療上の重要な標的分子となっています。私たちの研究室では、世界に先駆けて、さまざまな病期の脳内で認められるタウたんぱく病変や、α-シヌクレイン凝集体をヒト生体で可視化する技術開発に中心的に関わり、これらを用いた病態解明ならびに創薬過程促進に資する臨床研究を行ってきました1-5)。
1. 脳の防御機構「脳機能リザーブ」の本態とは︖
これまで一連の研究を行う中で、脳内に異常たんぱくの蓄積を認めながら、明らかな神経障害を呈さない方が散見されることに気づきました。これは以前より病理学的にもそのような症例がいることが報告されていて、高齢になっても異常たんぱくの蓄積が軽度にとどまる、もしくは異常たんぱくの蓄積を認めても脳機能が保たれる現象は「(広義の)脳機能リザーブ」と呼ばれています。しかし、脳機能リザーブの本態は、いまだ十分には明らかになっていません。生体内には異常たんぱくを脳内から除去するシステムがあり、オートファジー-リソソーム系やユビキチン-プロテアソーム系はその代表例となります。この異常たんぱく処理システムについては、次のようなことが明らかになっています。すなわち、①その異常が神経変性疾患発症のリスクとなる遺伝子の多くは、異常たんぱくの処理システムに関連するもので、②処理システムの機能は加齢によって低下し、さらに③加齢が発症のリスク要因となる神経変性疾患、循環器疾患、内分泌疾患、肝疾患などにおいても、病態への関与が想定されています。以上のことから、私たちははこの異常たんぱくを除去するシステムの機能低下こそが、加齢現象の一端を担うものであり、同年代の人と比べて相対的に異常たんぱく処理システムの機能が保たれている状態こそが、脳機能リザーブの本態であると考えました。
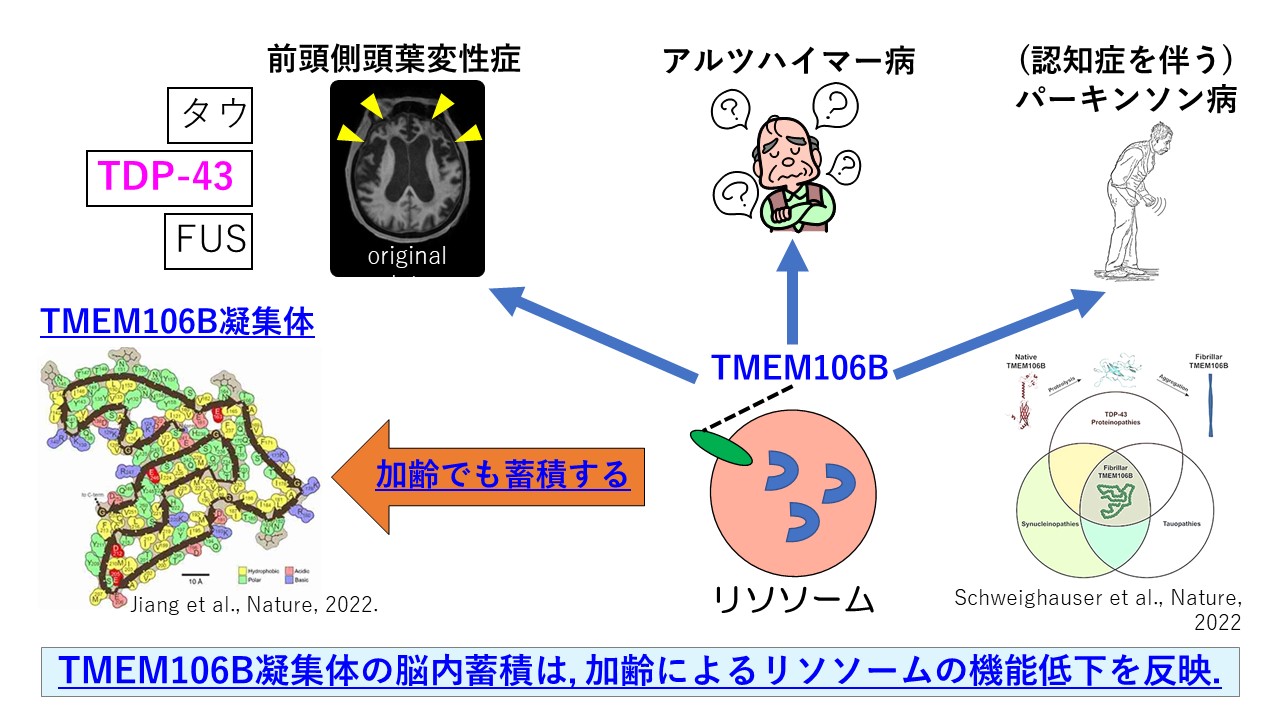
2. TMEM106B凝集体の発見
近年、クライオ電顕を用いて、脳内異常たんぱくの立体構造を解明する研究が盛んにおこなわれていますが、最近興味深いいくつかの報告がなされました。前頭側頭葉変性症患者においては、さまざまな脳内異常たんぱくが見られることが知られています。その中でもTDP-43の凝集体が見られる患者さんの死後脳を用いて、クライオ電顕でその立体構造を明らかにしようとしたところ、TDP-43ではなくTMEM106Bの凝集体が認められたことが報告されました6)。TMEM106Bはリソソームの膜貫通たんぱくであり、その遺伝子異常はリソソーム機能低下を介して、さまざまな神経変性疾患のリスク要因となることが知られています。またTMEM106B凝集体は、前頭側頭葉変性症だけでなく、さまざまな神経変性疾患の脳内で認められ、さらに加齢によっても蓄積することが報告されています6,7)。これらのことから、TMEM106B凝集体の脳内蓄積は、加齢によるリソソーム機能低下を反映する指標となると考えられます。
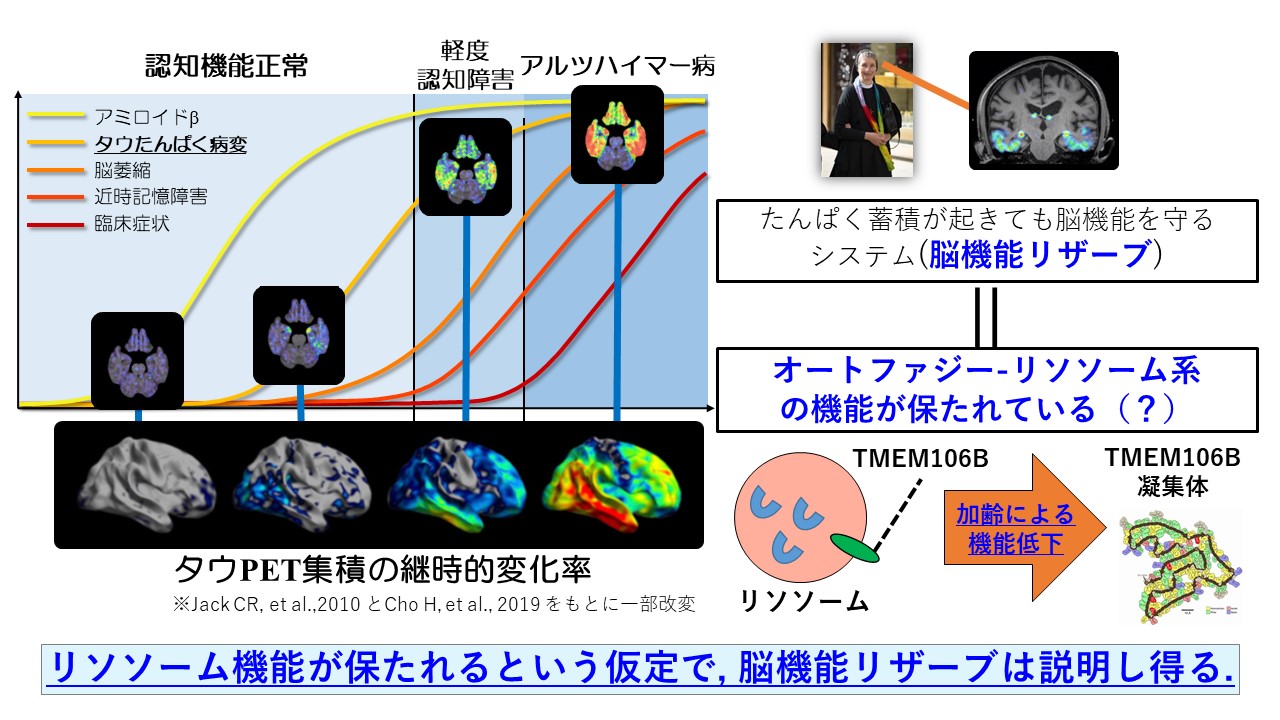
3. オートファジー-リソソーム系の働きと脳機能リザーブ
神経変性疾患の代表的疾患におけるアルツハイマー病においては、臨床症状が出現する10-20年ほど前から脳内のアミロイドβやタウたんぱくの脳内蓄積が始まると想定されていますが、タウ蓄積の経時的な変化は、局所におけるタウ蓄積量が多くなるほど加速度的に早くなることが明らかになっています8,9)。脳機能リザーブの本態が異常たんぱくの処理システムであるオートファジー-リソソーム系の機能が保たれていることだと仮定すると、タウ蓄積が比較的軽度にとどまる、もしくはタウ蓄積が重度になっても経時的なタウ蓄積の変化が緩徐となり、異常たんぱく蓄積が見られても臨床症状発現までに時間を要して、機能が保たれる期間が長くなるということで、脳機能リザーブは説明し得ます。
さいごに
私たちの研究室では2023年度より、国立研究開発法人 科学技術振興機構(JST)による創発的研究支援事業(https://www.jst.go.jp/souhatsu/)などの支援の下に、脳加齢を評価する全く新しい技術として、脳内のTMEM106B凝集体をヒト生体で定量可視化するイメージング技術の開発を行っていきます。本技術の開発には、私たちがこれまで取り組んできたタウたんぱく病変やα-シヌクレイン凝集体を可視化する研究で培った、知識と技術を応用することが出来ます。さらにTMEM106Bは脳以外にも、内分泌組織、心筋、肝臓、精巣など、エネルギー代謝が豊富な諸臓器を中心に、全身に発現しています。これらは加齢色素と言われるリポフスチンが良く観察される部位でもあり、これらの領域においてもリソソーム機能低下を反映してTMEM106B凝集体が認められる可能性があります。すなわち私たちが開発する脳加齢評価イメージング技術は、そのまま全身の生体老化を評価する技術としても利用できる可能性があり、将来的には全身多臓器の生体老化評価を実現できるものと期待されます。
現在は異なる臓器、異なる疾患ごとにその病態解明と治療法の開発が行われていますが、これは異なる領域間での知見の共有がされづらく、新薬の開発を行う上でも、日常の診療を行う上でも、効率的ではありません。将来的には全身多臓器の領域ごとの生体老化評価の結果に基づく、病気の予防と治療を行うという、新しい予防・治療戦略の確立につなげていきたいと考えています。
参考文献
- Matsuoka K, Ono M, Takado Y, Hirata K, Endo H, Ohfusa T, Kojima T, Yamamoto T, Onishi T, Orihara A, Tagai K, Takahata K, Seki C, Shinotoh H, Kawamura K, Shimizu H, Shimada H, Kakita A, Zhang MR, Suhara T, Higuchi M. High-Contrast Imaging of α-Synuclein Pathologies in Living Patients with Multiple System Atrophy. Mov Disord. 2022;37(10):2159-2161.
- Endo H, Tagai K, Ono M, Ikoma Y, Oyama A, Matsuoka K, Kokubo N, Hirata K, Sano Y, Oya M, Matsumoto H, Kurose S, Seki C, Shimizu H, Kakita A, Takahata K, Shinotoh H, Shimada H, Tokuda T, Kawamura K, Zhang MR, Oishi K, Mori S, Takado Y, Higuchi M. A Machine Learning-Based Approach to Discrimination of Tauopathies Using [18 F]PM-PBB3 PET Images. Mov Disord. 2022;37(11):2236-2246.
- Tagai K, Ono M, Kubota M, Kitamura S, Takahata K, Seki C, Takado Y, Shinotoh H, Sano Y, Yamamoto Y, Matsuoka K, Takuwa H, Shimojo M, Takahashi M, Kawamura K, Kikuchi T, Okada M, Akiyama H, Suzuki H, Onaya M, Takeda T, Arai K, Arai N, Araki N, Saito Y, Trojanowski JQ, Lee VMY, Mishra SK, Yamaguchi Y, Kimura Y, Ichise M, Tomita Y, Zhang MR, Suhara T, Shigeta M, Sahara N, Higuchi M, Shimada H. High-Contrast In Vivo Imaging of Tau Pathologies in Alzheimer's and Non-Alzheimer's Disease Tauopathies. Neuron. 2021;109(1):42-58.e8.
- Shimada H, Kitamura S, Shinotoh H, Endo H, Niwa F, Hirano S, Kimura Y, Zhang MR, Kuwabara S, Suhara T, Higuchi M. Association between Aβ and tau accumulations and their influence on clinical features in aging and Alzheimer's disease spectrum brains: A [11C]PBB3-PET study. Alzheimers Dement (Amst). 2016;6:11-20.
- Maruyama M, Shimada H, Suhara T, Shinotoh H, Ji B, Maeda J, Zhang MR, Trojanowski JQ, Lee VM, Ono M, Masamoto K, Takano H, Sahara N, Iwata N, Okamura N, Furumoto S, Kudo Y, Chang Q, Saido TC, Takashima A, Lewis J, Jang MK, Aoki I, Ito H, Higuchi M. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 2013;79(6):1094-108.
- Schweighauser M, Arseni D, Bacioglu M, Huang M, Lövestam S, Shi Y, Yang Y, Zhang W, Kotecha A, Garringer HJ, Vidal R, Hallinan GI, Newell KL, Tarutani A, Murayama S, Miyazaki M, Saito Y, Yoshida M, Hasegawa K, Lashley T, Revesz T, Kovacs GG, van Swieten J, Takao M, Hasegawa M, Ghetti B, Spillantini MG, Ryskeldi-Falcon B, Murzin AG, Goedert M, Scheres SHW. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature. 2022;605(7909):310-314.
- Jiang YX, Cao Q, Sawaya MR, Abskharon R, Ge P, DeTure M, Dickson DW, Fu JY, Ogorzalek Loo RR, Loo JA, Eisenberg DS. Amyloid fibrils in FTLD-TDP are composed of TMEM106B and not TDP-43. Nature. 2022;605(7909):304-309.
- Jack CR Jr, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, Petersen RC, Trojanowski JQ. Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. Lancet Neurol. 2010;9(1):119-28.
- Cho H, Choi JY, Lee HS, Lee JH, Ryu YH, Lee MS, Jack CR Jr, Lyoo CH. Progressive Tau Accumulation in Alzheimer Disease: 2-Year Follow-up Study. J Nucl Med. 2019;60(11):1611-1621.