(2022年5月10日公開)
担当:田井中 一貴 先生
所属:システム脳病態学分野
はじめに

図1 ヒト剖検脳サンプル組織透明化・ホールマウント免疫染色の実験スキーム
現代の組織病理学は、19世紀後半Rudolf Virchowにより提唱された「細胞病理学」に基づいており、光学顕微鏡を用いた2D組織切片における細胞の異常の観察により体系化されてきた。2D組織染色技術として代表的なHE染色や特殊染色、免疫染色は、今もなお現代の医学における診断を支える基盤技術となっている。機能が殊更複雑なヒト脳などの臓器においては、2D画像に加えて、立体的な形態変化の観察が求められてきた。しかしながら、3D画像を得るためには、1枚1枚全ての切片画像を観察し、それらの画像を立体像として再構成するという膨大な労力と時間を要するプロセスが必要とされる。従って、原理的には可能ではあるものの診断における一般的な観察手法としては定着には至らなかった。ところが、近年、組織サンプルを光学的に透明化し、薄く平面上に広げたレーザー光照射により、高速に光学的な断層像を取得する「組織透明化・3Dイメージング技術」が開発され、3D画像に基づく病理診断技術への道が拓かれた。以前のコラムではマウス脳の透明化に関する技術を紹介したが、本稿では、ヒト脳剖検組織サンプルの組織透明化およびホールマウント免疫染色技術について解説する(図1)。
1.ヒト脳組織の脱脂および脱色

図2. 脱脂処理の違いによるヒト脳切片の透明度比較
※2 mm 厚ヒト脳切片に対して 5 時間、 45 ℃の脱脂処理を行った。
過酸化水素による脱色は行わず、脱脂後 CUBIC-R により屈折率調整を行った。
ヒト脳の大半は白質から構成されており、マウス脳とは比較にならないほど脂質含量が多く、多くの組織透明化法において、この過程を乗り越えることが難しい。マウス脳の脱脂処理で典型的に用いられているドデシル硫酸ナトリウム(SDS)により、5 mmブロックのヒト脳白質小片に対して、脱脂処理を完了するためには、数週間から数か月も必要とする。筆者らはこれまでに、1600種類以上の水溶性透明化試薬のケミカルプロファイリングにより、LogP値の高い水溶性化合物が、脱脂に有効であることを見出した1)。中でも、化粧品材料としても用いられている1,2-Hexanediol(HxD)は、以前、筆者らが開発したマウス臓器用脱脂試薬のCUBIC-L(以下、CU-L。組成はN-ブチルジエタノールアミンおよびTriton X-100の10 wt%混合水溶液からなる。)よりも脱脂活性が高い界面活性剤であり、5 mmブロックの白質小片に対して2-3日程度で脱脂を完了させることができる2)(図2)。脱脂済みのサンプルに対して、(PBS)置換により洗浄後、0.1-1% H2O2-PBS(1 cmブロックに対して40 ml程度)に入れ、37-45℃で振盪させる。過酸化水素処理は、組織に対する損傷を惹起するため、設定条件には注意を要する。大脳皮質サンプルをHxD脱脂により処理する場合、1% H2O2-PBS、45℃、3-5日間が適している。一方、大脳皮質サンプルをCU-L脱脂により処理する場合、0.1% H2O2-PBS、45℃、3日間以上の強度で処理すると標本が極めて脆弱化する。過酸化水素の使用における注意点として、試薬そのものの安全性だけでなく、希釈した過酸化水素が劣化しやすいことが挙げられる。従って、過酸化水素のPBS希釈液は用時調製を推奨する。
2.ホールマウント免疫染色
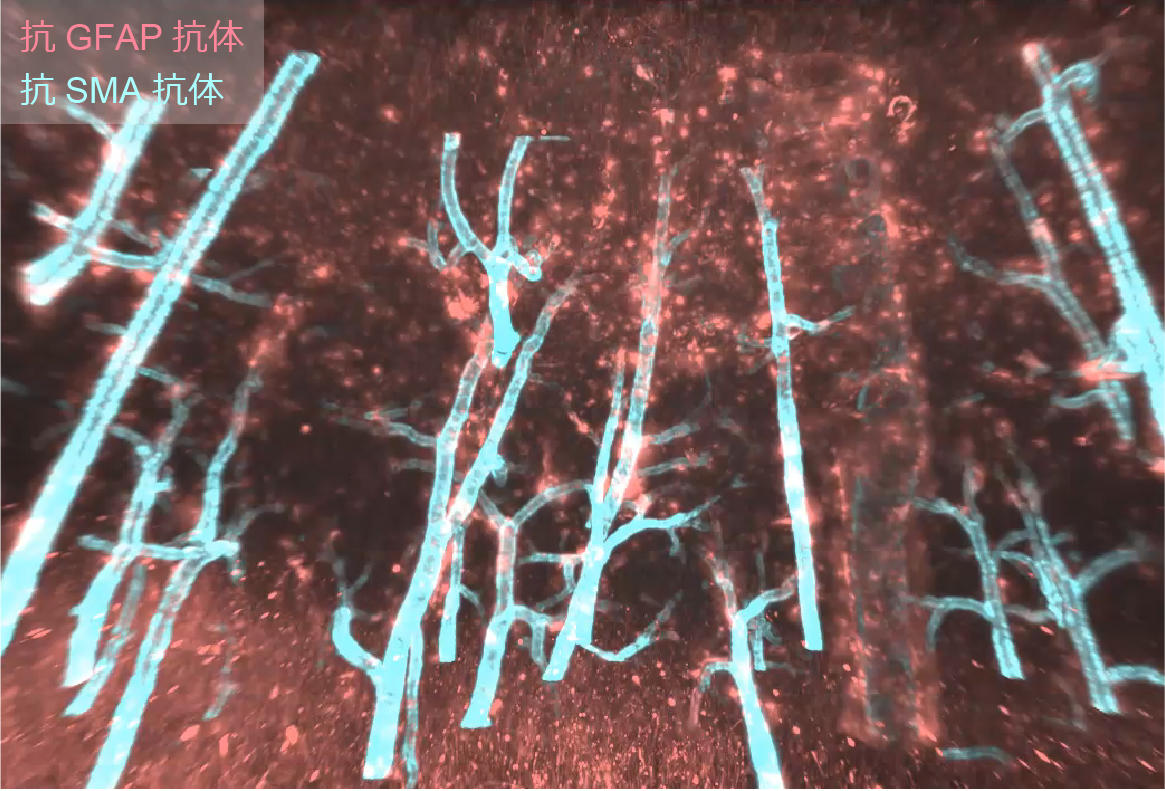
図3. ヒト脳大脳皮質における 3D 免疫染色イメージング画像
抗体を用いた染色では、一次抗体・二次抗体の段階的な染色プロトコールは、検証に必要なパラメータが多く存在するため条件検討が難しい。可能な限り蛍光標識が導入された一次抗体を用いることを推奨する。蛍光標識抗体が存在しない場合には、市販の蛍光標識キットを活用する。例えば、Dojindoから販売されているHiLyte FluorTM Labeling Kitは、比較的安価に購入できる標識キットであり、異なる2種類の蛍光波長の色素で抗体を標識することが可能である。染色後の処理において注意すべきもう一つのポイントは、抗体の中には染色時には標識できているものの、最終の屈折率調整過程で染色性が失われるものがあることである。従って、染色後速やかに屈折率調整に移行するのではなく、追加のホルマリン固定処理を行ってから屈折率調整を実施することを推奨する。
図3に抗SMA抗体および抗GFAP抗体を用いたホールマウント免疫染色のイメージング画像の例を示す。染色用の緩衝液は、PBST(0.5% Triton X-100、0.25% カゼイン、0.01% アジ化ナトリウム)溶液を用いる。カゼインは溶解しにくいので、加熱・撹拌により完全に溶解させる。5 mmヒト脳大脳皮質ブロックに対して、100倍希釈濃度の抗体を溶解させたPBST溶液を用いて室温下で5-7日程度染色する。PBSで3回ほど洗浄後、1% ホルマリン-PBS液で室温下5時間反応させ、屈折率調整過程に移行する。
3.ヒト脳組織の透明化
透明化には大きく分けて2通りの試薬がある。一つは、CUBIC-R(CU-R)や造影剤に代表される水溶性の透明化試薬であり、もう一つは、BABB(ベンジルアルコールと安息香酸ベンジルの混合溶媒)などの有機溶剤による透明化試薬である。ヒト脳などの軟組織については水溶性透明化試薬でも十分な透明度が得られるが、骨組織などの硬組織や脂肪が含まれる組織に対しては有機溶剤による透明化試薬を用いる必要がある。ただし、有機溶剤による透明化は、脱水過程を含むために、パラフィン包埋時と同じ程度組織が収縮することに留意する必要がある。両者のプロトコールについて概説する。
水溶性透明化試薬であるCU-Rによる透明化手法について紹介する。CU-Rは、鎮痛解熱薬の一つであるアンチピリン(45 wt%)と水溶性ビタミンであるニコチンアミド(30 wt%)からなる混合水溶液(残りの25 wt%は蒸留水)である。アミノアルコール等を用いてpHを塩基性に調整することで、組織の膨潤が惹起される。透明度の観点では塩基性に調整した方が透明度は優れている。染色が終了したサンプルをPBS置換により洗浄後、蒸留水で2倍に希釈した1/2 CU-R液(1 cmブロックに対して15 ml程度。以下同じ容量を使用)に入れ、室温で6時間以上振盪させる。続いて、原液のCU-R液に置換して室温で7-8時間以上振盪し、原液のCU-R液を再び置換して室温で12時間以上振盪させることで完了する。なお、図3の実験ではCU-Rを用いた。
続いて、有機溶剤として代表的なBABBによる透明化手法を紹介する。染色が終了したサンプルをPBS置換により洗浄後、30%メタノール水溶液(1 cmブロックに対して30-40 ml程度。以下同じ容量を使用)に置換する。室温で6時間振盪させた後、アルコール濃度を60%から80%、100%と上げていき、それぞれ6時間から終夜室温にて振盪させる。100%メタノールに再度置換して6時間以上振盪させた後、BABB(ベンジルアルコール:安息香酸ベンジル=1:2の混合溶液)に置換し、室温で6時間以上振盪させる。最後に、BABBを置換し、室温で12時間以上振盪させることで完了する。
おわりに
組織透明化の化学的原理の理解が進むことで、ようやく病理学への応用の道が拓かれつつあるが、組織の損傷を伴わない脱色条件の探索や、高速の免疫染色手法の確立は引き続き重要な課題となろう。今後これらの課題が解決した暁には、組織透明化・3Dイメージングが病理診断において必須な汎用技術になることが期待される。
参考文献
1) Tainaka, K., Murakami, T.C., Susaki, E.A. et al.: Chemical Landscape for Tissue Clearing Based on Hydrophilic Reagents. Cell Rep 2018, 24: 2196-2210.e9
2) Inoue, M., Saito, R., Kakita, A. et al.: Rapid chemical clearing of white matter in the post-mortem human brain by 1,2-hexanediol delipidation. Bioorg Med Chem Lett 2019, 29(15):1886-1890





