(2021年9月3日公開)
担当:岩倉 百合子 先生
所属:腫瘍病態学分野
1. はじめに
私達の体は様々な組織や器官(臓器)が複雑に協働することで成立していますが、組織や臓器の最小単位となるのが細胞です。この細胞の一生(増殖から細胞死まで)をコントロールするのが「成長因子 (Growth factor)」という分泌性のタンパク質です。成長因子は、体内(動物)で、様々な細胞の増殖や分化(どのような細胞になるかが決まること)を促進する作用を持ちます。現在までに100種類以上の成長因子が同定されていますが、今回は古典的な成長因子の一つである上皮成長因子(Epidermal Growth Factor; EGF)の、神経細胞に対する作用と脳神経疾患への関わりについて紹介します。
2. EGFとEGF受容体(EGFR)
EGFは唾液腺に多く含まれ、マウス新生仔の成長を促進する物質として、1962年にスタンリー・コーエンらにより発見されました。彼らは唾液腺からの抽出物を新生仔に投与すると、この瞼の開きや切歯(前歯)の生え始めが早くなること、その作用本体が53アミノ酸からなる小さいタンパク質であることを報告しました1,2。神経成長因子(NGF, 本コラム「神経栄養因子の話」を参照)を発見したリータ・レーヴィ=モンタルチーニと共に、コーエンはノーベル生理学・医学賞を受賞しました。
EGFが細胞表面に存在する上皮成長因子受容体 (EGFR、ErbB1)に結合すると、EGFRが活性化し、細胞内へシグナル伝達を行います(図1B)。EGFとEGFRは様々な細胞に広く発現しています。EGF/EGFRシグナルは細胞の増殖や分化、成熟に加え、細胞外マトリックスと呼ばれる細胞外構造の分解、それに伴う細胞移動など、生体のあらゆる局面で重要な役割を担います。また、人工多能性幹細胞(iPS細胞)や胚性幹細胞(ES)研究においても、その増殖や分化に必須であることが知られています。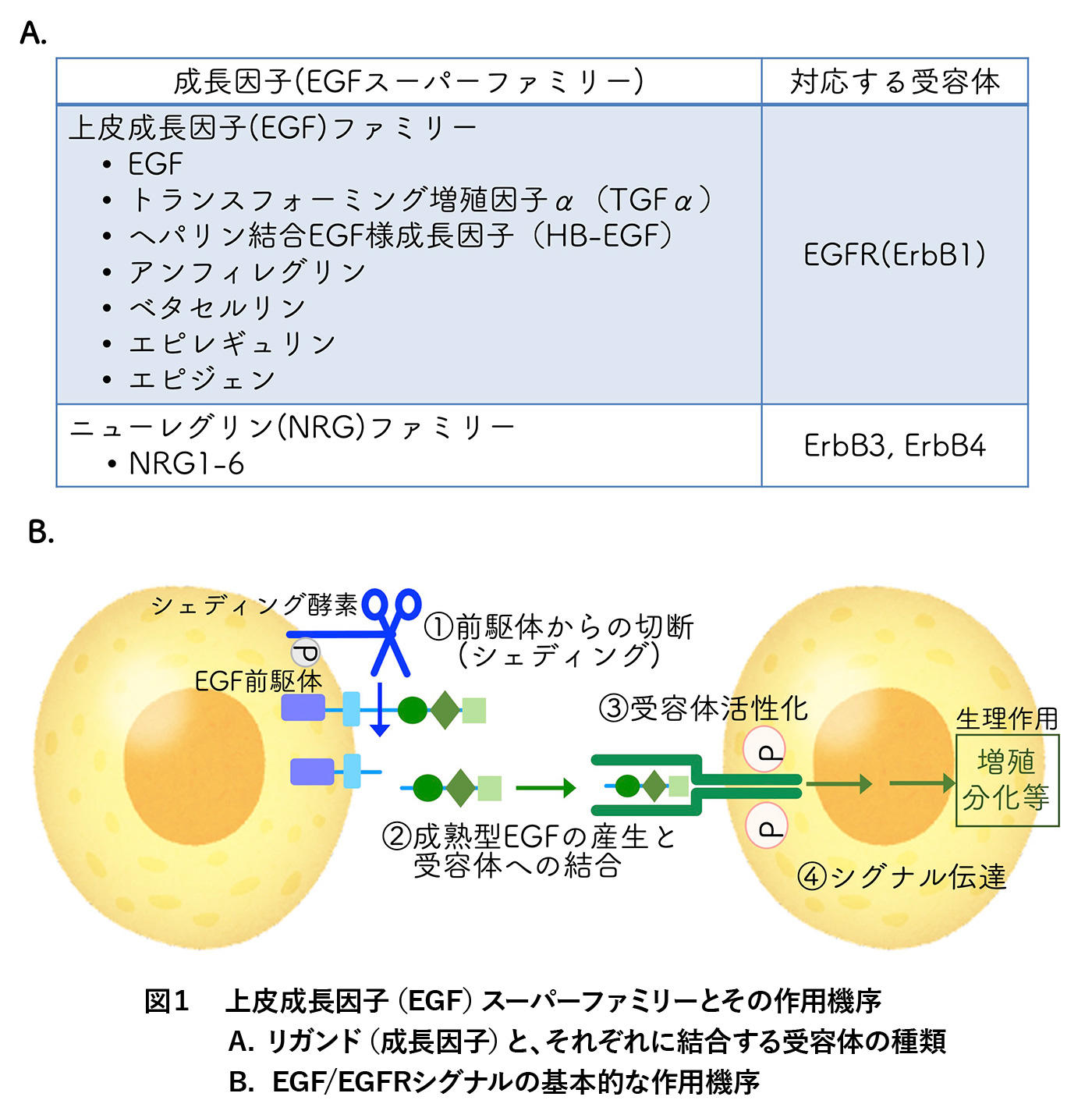
3. EGFと脳神経疾患
EGF/EGFRシグナルは疾患への関与についても広く研究されています。特に進んでいるのはがん研究分野です。多くのがん細胞では、EGF生産が過剰になることがあるだけでなく、EGFRの遺伝子変異により、活性が過剰になっている(EGFが無くても活性化した状態にある)こと、それらが過剰・異常な細胞増殖(がん化)や、がん細胞の他の臓器への転移等の一因となることが分かっています(図2B)。このようにEGFは「増殖する」細胞の一生を司る物質としての研究が主でした。加えて近年は、脳細胞、特にそれ自身では「増殖しない」神経細胞に対する研究も進められています。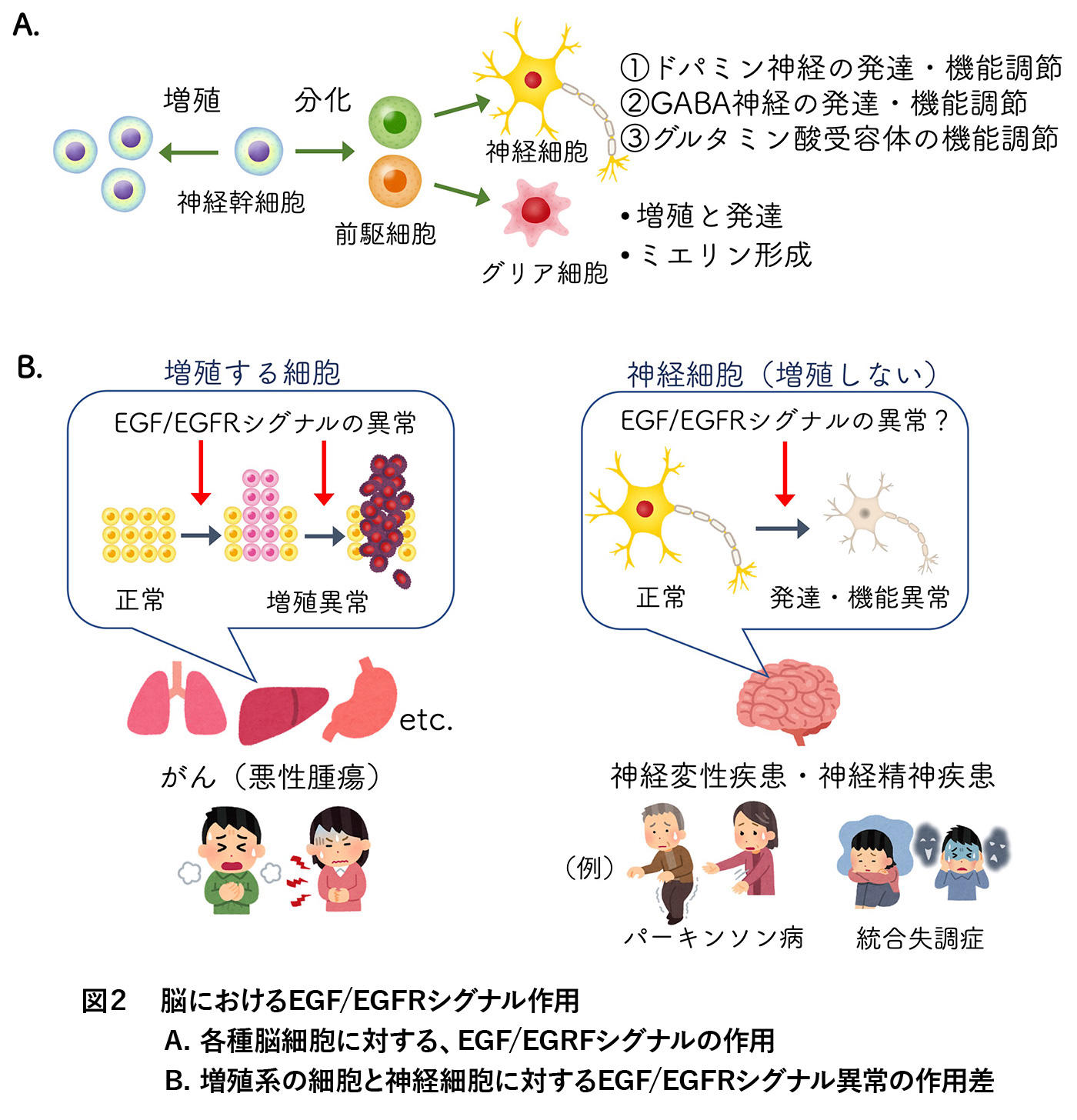
3.1 神経細胞に対するEGF/EGFRの作用
EGFはEGFRとともに脳の様々な細胞にも広く発現しています。増殖という点では、脳に存在する神経幹細胞や神経前駆細胞、グリア細胞の増殖や成長に関わります。しかし、例えばヒトでは生後しばらく過ぎると、神経細胞の数はほぼ増加しません。増殖もせず分化も終了した神経細胞に対して、EGFはどんな役割を持つのでしょうか。
神経細胞は、細胞同士で信号(情報)をやりとりすることで、必要な情報を伝達(処理)しています。信号を物理的にやり取りするために使われるのが、「神経伝達物質」です。神経細胞は、使用する神経伝達物質の種類によっても分類されます。中でも①「ドパミン(DA)」を用いるドパミン性神経細胞、②「γ-アミノ酪酸(GABA)」を用いるGABA性神経細胞、③「グルタミン酸(Glu)」とその受容体、に対して、EGFは細胞の機能的・形態的発達(①②)や、受容体の機能調節に関与することが明らかになりました3,4,5(図2A)。さらには、このようなEGFの作用が、上記の神経細胞種に関連する脳機能や中枢神経疾患にも関与することが報告されています(図2B)。
3.2 パーキンソン病(神経変性疾患)
神経変性疾患とは、特定の(領域の)神経細胞が、徐々に形態的・機能的に退行(変性)し、その領域の神経群が司る機能に障害が出る病気です。パーキンソン病では脳の黒質から線条体に向かうドパミン神経細胞が特異的に変性してしまい、運動機能が損なわれます。日本での罹患率は100-150人/10万人と言われています。前述のようにEGFはドパミン神経細胞の形態的・機能的発達に必要です3。パーキンソン病患者さんの死後脳や疾患モデル動物の黒質・線条体では、実際にEGFとEGFRのタンパク発現量が減少しています。さらに、疾患モデル動物では、EGFの局所(黒質)投与により、ドパミン産生の律速酵素であるチロシン水酸化酵素の発現が線条体で回復することが報告されています6 (図3A)。
また、パーキンソン病の原因遺伝子の一つであるparkinは、正常時にはEGFR下流シグナル調節に関与します7。EGFスーパーファミリーの一つであるNRG1についても、患者の脊髄液ではNRG1(SMDF)タンパク量が減少することが報告されています8。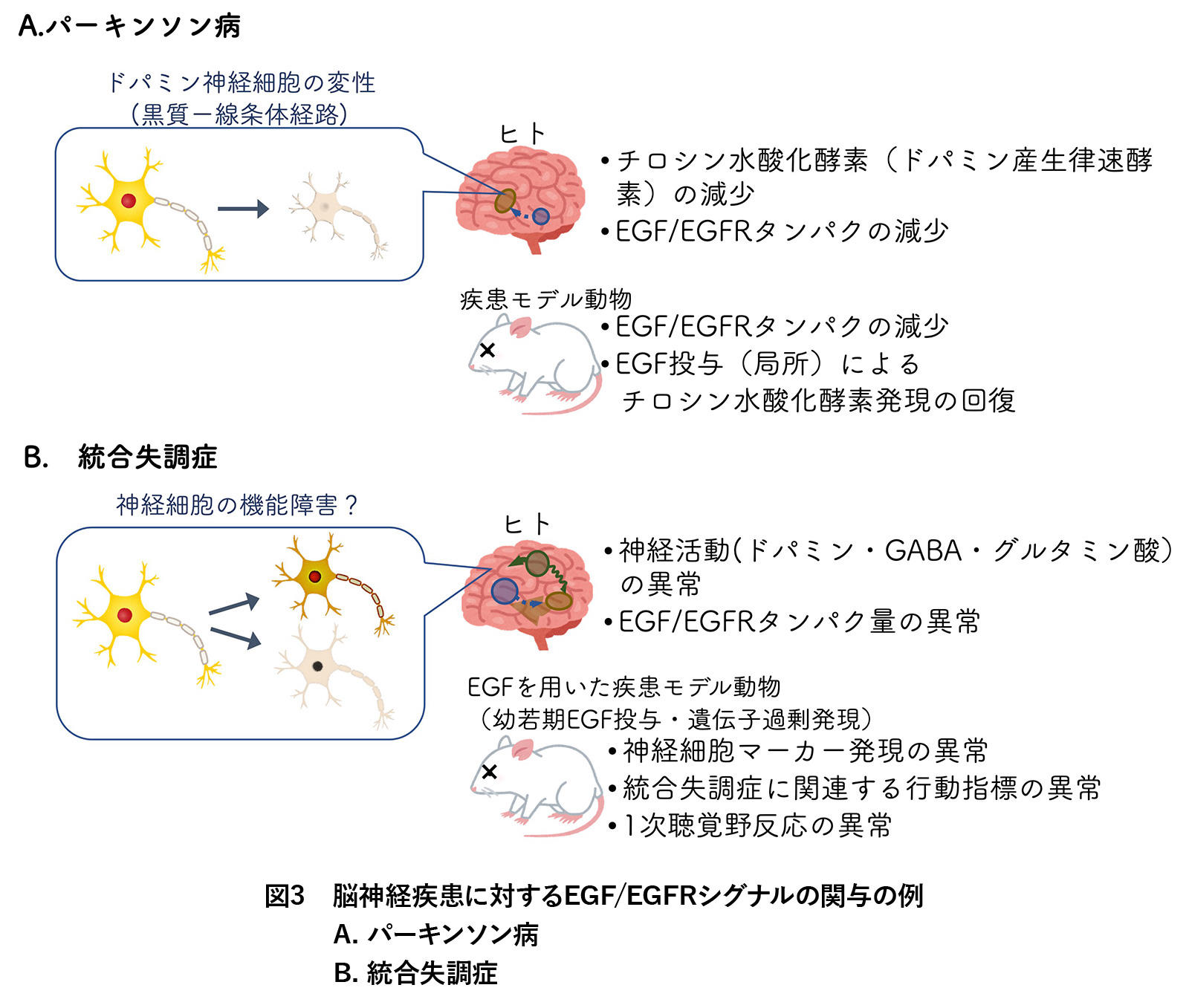
3.3 統合失調症
罹患率は100人に1人とされ、多くは思春期以降に発症することが報告されています。脳の発達は思春期頃まで続くことから、その発達段階での機能的異常が、思春期以降の発症要因となる可能性が示唆されています。統合失調症の発症や病態に関与する遺伝子群が多岐にわたることも明らかになってきました。現在、神経伝達機能に関連する主な病態仮説として、①ドパミン神経細胞の機能亢進(ドパミン仮説)、②GABA 神経細胞の機能低下(GABA仮説)、③グルタミン酸受容体の機能低下(グルタミン酸仮説)、の3点が広く研究されています。これらの仮説に関与する神経細胞群に対して、EGFが形態的・機能的な発達調節に関わることから、EGFは仮説間をつなぐ共通項の1つである可能性があります。実際に、統合失調症患者死後脳の前頭前野では、EGF量の減少と受容体EGFR量の上昇が見られること9、EGFシグナルを成長期に撹乱した疾患モデル動物の成体では、統合失調症に関連する行動指標に影響が現れることが報告されています10,11 (図3B)
また、睡眠障害は精神疾患の前駆症状や臨床症状の一つでもありますが、EGF/EGFRシグナルは、マウスの視床下部で概日リズム(体内時計)の調節に関与していることも報告されています12。
4 終わりに
EGFの産生・放出は、細胞表面でのシェディング(切断酵素による細胞外部分からの切り出し)機構により行われます(図1B)。切断酵素の活性化をもたらす刺激は関節的にEGFRの活性化を促すことから、EGFの産生・放出機構自体が、細胞に対する独立した機能スイッチとなりえます。神経細胞においても、ドパミンなどの神経伝達物質がEGFファミリー分子のシェディングを促進することが報告されています13,14。このシェディング機構は、アルツハイマー病の原因蛋白であるアミロイドベータの産生機構でもあり、切断酵素もEGFシェディングを行う切断酵素と共通しています15。脳神経系においても、このようなEGFの産生・放出から受容体活性化までのプロセスを明らかにすることで、EGF/EGFRシグナルの理解が脳機能や様々な疾患研究の新しい局面をもたらす一助となることが期待されます。
参考文献
- Cohen S, J. Biol. Chem., 1962 May;237:1555-62.
- Taylor JM et al., J. Biol. Chem., 1972 Sep 25;247(18):5928-34.
- Iwakura Y et al., J Neurochem., 2011 Jul;118(1):57-68.
- Namba H et al., J Neurochem., 2017 Sep;142(6):886-900.
- Namba H et al., Neuroscience. 2009 Feb 18;158(4):1731-41.
- Iwakura Y et al., J Neurochem. 2005 May;93(4):974-83.
- Fallon L et al., Nat Cell Biol. 2006 Aug;8(8):834-42.
- Hama Y et al., Neurosci Lett. 2015 Feb 5;587:17-21.
- Futamura T et al., Mol Psychiatry. 2002;7(7):673-82.
- Nawa H et al., Biomed Res Int. 2014;2014:697935.
- Jodo E et al., Sci Rep. 2019 May 16;9(1):7503.
- Kramer A., Science. 2001 Dec 21;294(5551):2511-5.
- Iwakura Y et al., J Neurochem. 2011 Jul;118(1):45-56.
- Iwakura Y et al., PLoS One. 2017 Mar 28;12(3):e0174780.
- De Strooper B. et al., Nat Rev Neurol. 2010 Feb;6(2):99-107.





