(2021年1月20日公開)
担当:鈴木 雄治 先生
所属:統合脳機能研究センター
"発達"を客観的に評価する方法の開発は、自閉症や学習障害をはじめとした様々な発達障害の診断のみならず発症メカニズムの解明や様々な治療介入の効果判定に役に立つ。しかしながら、"発達"という小児科医が直面する神経学的変化は単なる成長というような単純なものではないため、現在まで十分な解析方法の開発には至っていない。
DNA異常にその解答を求めることが進んでいるが、それはあくまで一部の発達障害に特有な異常の有無の検出であって、異常部位の描出や脳機能のメカニズム異常の解明には直接結びつかない。もちろん、通常のCT・MRIの画像でサイズや形態の解析を行っても結果は同様である。胎生期からの急激な変化など形態から観察可能な部分もあるが、出生後の発達に伴う変化としては、神経回路網の再編や髄鞘化などの微細な構造変化、それに伴う機能変化などがあげられ、これらの変化は従来の形態をみる画像学で観察することは困難である。
水素原子を信号源とするMRI装置は、撮像原理を理解し利用することにより更なる生体情報を検出することが可能になる。これらの情報は、発達をはじめとする小児特有の変化を観察する可能性を秘めている。
統合脳機能研究センターでは、発達に伴う微細構造・神経回路・脳機能といった変化に注目し、その変化をMRI装置を用いて観察・解析することにより、発達及び発達障害に対するアプローチの開発を行っている。
撮像準備:プレパレーションシステム
小児を対象としMRIの撮像をする場合には、鎮静をはじめとする撮像に対する様々な困難さ(撮像環境・体動抑制・撮像時の騒音・小児にとっては長い撮像時間等)のため、そのポテンシャルを充分には活かしていないのが現状といえる。
統合脳機能研究センターでは、実際に撮像する際に安全かつ快適に遂行できるよう、様々な対策をとっている。鎮静のための薬剤投与は形態異常を描出する際には、結果に大きな影響を与えることはないため臨床現場では、しばしば使用されている。しかしながら、発達に伴う生理学的及び機能的な解析をする際には大きな影響を与えることが予想される。さらに安全面においても薬剤投与は問題があることから、当センターでは薬剤を使用することなく撮像を行っている。その遂行を可能にするために、ゼロテスラ・プレパレーションシステムを導入している(図1)。 磁場のない装置で実際に撮像する際と同じ状況を安全に再現することができるため、このシステムで事前に撮像の体験を練習することにより、様々な発達障害を持つ被験者の不安を取り除き、無麻酔科での撮像が可能となっている。時には何度かトレーニングが必要となることがあるが、撮像に対して十分に慣れ、装置などへの不安を取り除いたのを確認した後に実際の撮像を開始することを優先している。さらに、MRI装置に対応した視聴覚システムを利用し、お気に入りの音楽や映像を視聴しながら撮像することで恐怖や不安を低減することも併せて行い、学童前の年少者や発達に問題を抱える児童であっても安全な撮像が可能となっている1)。
磁場のない装置で実際に撮像する際と同じ状況を安全に再現することができるため、このシステムで事前に撮像の体験を練習することにより、様々な発達障害を持つ被験者の不安を取り除き、無麻酔科での撮像が可能となっている。時には何度かトレーニングが必要となることがあるが、撮像に対して十分に慣れ、装置などへの不安を取り除いたのを確認した後に実際の撮像を開始することを優先している。さらに、MRI装置に対応した視聴覚システムを利用し、お気に入りの音楽や映像を視聴しながら撮像することで恐怖や不安を低減することも併せて行い、学童前の年少者や発達に問題を抱える児童であっても安全な撮像が可能となっている1)。
微細構造の発達:Diffusion Tensor Imaging
発達に伴う変化の一つに白質の髄鞘化があげられる。髄鞘化の進行過程は、脳内の部位により異なることはすでに報告されており、例えば、錐体路や視放線の髄鞘化は生後速やかに進行し1歳までには完成する一方で、皮質内連合、特に前頭葉においては思春期以降も進行する。このような発達の指標につながる髄鞘化の過程を非侵襲的に評価するには、MRIは有効な測定手段といえる。白質の髄鞘化をはじめとする発達により引き起こされる微細構造や機能の変化は、水分子の動態に影響を与えることが予想され、この現象は水分子の"見かけの拡散"の変化としてDiffusion Tensor Imaging(DTI) で定量的に3つの固有値(λ1,λ2,λ3)の変化として観察できる。
図2は、小児群(10歳以下) と若年成人群(18歳以上)の2群間の固有値を比較した結果である。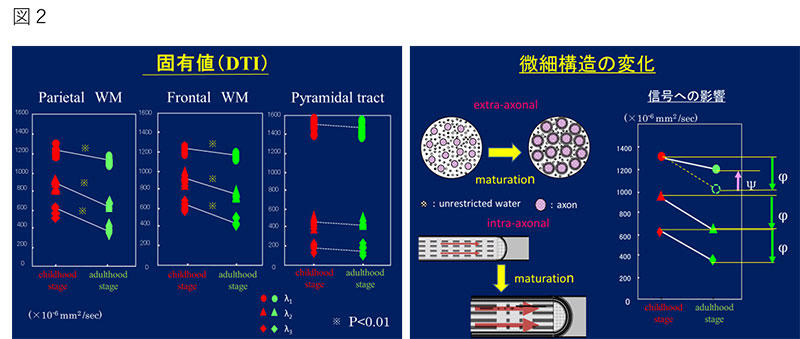 髄鞘化がすでに完成している錐体路では両者の間では固有値には変化は認められないが、髄鞘化の進行過程と考えられている前頭葉では年齢と共に全ての固有値が低下する。発達に伴う髄鞘化の進行とともに、水分子の拡散は制限されるが、軸索方向の拡散は活発に繰り広げられる軸索流などの影響で、観察される第一固有値(λ1)の低下は、それ以外の固有値(λ2,λ3)に比べて小さいことが示されている2)。このようにDTIを用いて検出された固有値の変化は、髄鞘化をはじめとした発達に伴う微細な構造の変化を反映していることを示唆している。この方法を適応することにより、今まで解明されることのなかったプラダー・ウィリ症候群3)や被虐待児4)において発達に影響を与えている発達異常部位(未発達部位)の解析結果を報告した。
髄鞘化がすでに完成している錐体路では両者の間では固有値には変化は認められないが、髄鞘化の進行過程と考えられている前頭葉では年齢と共に全ての固有値が低下する。発達に伴う髄鞘化の進行とともに、水分子の拡散は制限されるが、軸索方向の拡散は活発に繰り広げられる軸索流などの影響で、観察される第一固有値(λ1)の低下は、それ以外の固有値(λ2,λ3)に比べて小さいことが示されている2)。このようにDTIを用いて検出された固有値の変化は、髄鞘化をはじめとした発達に伴う微細な構造の変化を反映していることを示唆している。この方法を適応することにより、今まで解明されることのなかったプラダー・ウィリ症候群3)や被虐待児4)において発達に影響を与えている発達異常部位(未発達部位)の解析結果を報告した。
神経回路の発達:1H-MR Spectroscopy
ヒトの脳は小児期から成人期まで続くシナプスによる神経回路網の再編を通じて情報処理機能を構築する。脳の緻密な神経回路は、シナプスを生成したり不要なシナプスを取り除いたり(刈り込み)することで完成するのだが、幼児期以降は発達に伴いシナプス密度が低下することが観察されている。この変化を生体で直接観察することは困難であるが、神経回路網の再編に伴うシナプス数(密度)や神経細胞の変化は、シナプス周辺部に存在する神経伝導物質に影響をあたえることが示唆されることから、シナプス末端に豊富に存在する主要な興奮性神経伝達物質であるグルタミン酸(Glu)を観察することが間接的な評価につながると考えられる。生体脳にて非侵襲的にGluを観察可能な撮像方法が1H-MR Spectroscopy(MRS)である。MRSで観察される代謝物は、Glu以外にも、神経細胞に特異的に存在するアミノ酸であるN-acetylasuparate(NAA)、コリン化合物(Cho)、クレアチン(Cr)等が挙げられ、虚血性脳血管障害や脳腫瘍など様々な疾患に対して臨床応用されている。
図3は、前頭葉皮質のGlu/Cr、及びNAA/Crを測定し、小児群と若年成人群を比較した結果である。乳時期の脳成熟に関する研究で用いられることの多いNAAに関しては2群間で変化は認められなかったが、Gluは小児群に比べて成人群では優位に低下しており、発達に伴いGluが低下することが示された5)。この低下は神経回路網が成熟する過程、すなわち、シナプス密度の低下などの生理学的変化と矛盾せず、発達による変化を反映していることが示唆される。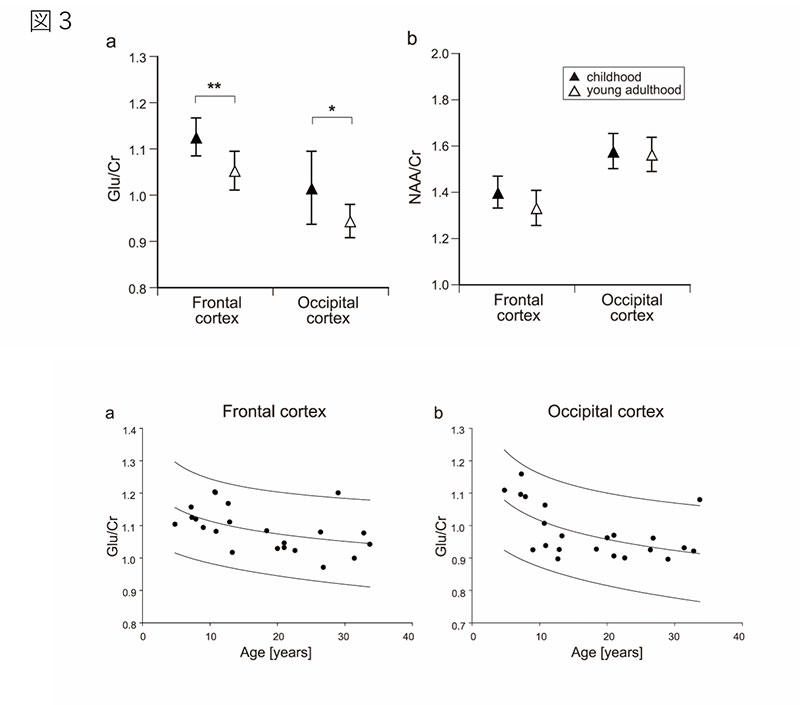
脳機能の発達:functional MRI
今まで述べてきた神経細胞の髄鞘化や神経回路の成熟といった脳の発達は、最終的には高次脳機能につながる。現在では非侵襲的に神経活動を視覚化し解析するニューロイメージング法としてfunctional MRI(fMRI)がひろく普及している。fMRIは、目的とする脳活動を行っている(賦活)時と安静時の撮像を繰り返し施行し、両者における信号強度を比較して機能解析する方法が一般的である。しかしながら、小児特に発達に問題を抱える児童を対象とするには、その両者の状態を一定時間保ちさらに切り替えて行うことは非常に困難なことから、さらなる解析方法の開発が必要であった。
近年、安静時の自発性脳活動のfMRI 信号から、離れた脳領域間の活動の相関を求め、グラフ理論により脳全体を情報ネットワークとみなして脳局所相互間のconnectivity(活動. の同期性)を推定する解析方法が提唱されている(resting state fMRI;rs-fMRI)。この方法は、小児でも遂行可能であるが、安静時におけるネットワークの成熟を解析可能となるが脳機能を直接評価するに至らない。そのため、我々は、脳波による脳機能解析で行われている事象関連電位の方法を応用して、加算平均にてfMRIの画像データを解析する事象関連時脳機能画像(event-related fMRI;er-fMRI)を開発し、自発的な行動や運動準備の調整に関する研究結果を報告した6)(図4)。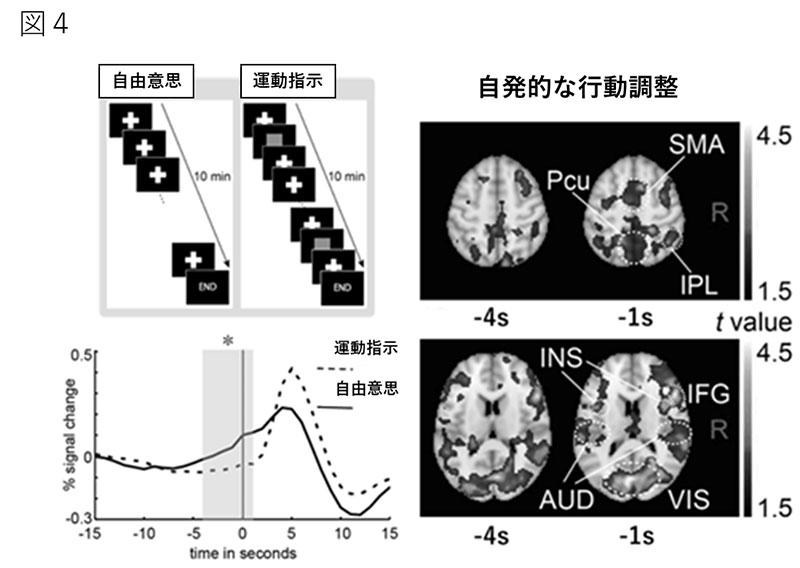
このような解析方法を駆使し更なる開発をすることにより、今まで観察できなかった発達に伴う脳機能の変化を描出することが可能になり、発達のメカニズムの解明や発達に問題を抱える児童の適切な介入(トレーニング)の評価にもつながると考えている。
発達を可視化するための今後の挑戦:7.0T-MRIに向けて
統合脳機能統合センターでは、微細構造、神経回路、脳機能の観点からMRIを用いた発達に対するアプローチの開発を行ってきた。これらの方法を駆使して、発達及び発達障害のメカニズムの解明を目指している。
現在まで、自閉症・学習障害をはじめとした様々な発達障害の発症メカニズムや脳活動を基盤とした主観的な神経基盤の機能解明はほとんどなされていない。我々は、従来の3.0T-MRIでは信号強度や空間分解能が十分でないことからノイズとして切り捨てられていた信号成分の中に、種々の発達障害の児童が抱える情報処理メカニズムの複雑さ(高エントロピー状態)を解き明かす鍵が存在するという考えのもと統計力学的手法に基づくエントロピー解析法を独自に開発し、7.0T-MRIにて撮像した高空間分解能rs-fMRIのエントロピー解析から、自閉症スペクトラムなどの神経発達症に特徴的な脳活動パターンや脳活動のネットワークを検出することを試みている。
MRIは3.0Tの高磁場装置から更なる可能性を求めて7.0Tといった超高磁場の装置へと発展してきている。超高磁場MRI装置は、高信号雑音比のみならず高空間及び周波数分解能を有し、DTIに関してはより詳細な解析が可能になり、またMRSにおいてもグルタミン酸(Glu)やグルタミン(Gln)のみならず抑制性神経伝達物質であるγ-アミノ酪酸(GABA)も同時に測定可能になり、rs-fMRIのエントロピー解析を含めたさらなる検討が小児の脳発達の客観的な評価につながることが期待される。
参考文献
-
Participant-driven simulation protocol with a mock scanner for pediatric magnetic resonance neuroimaging preparation without sedation. Yamada K, Suzuki Y, Ueki S, Itoh K, Watanabe M, Suzuki K, Igarashi H. Clin Simul Nurs. 2020(47):40-47. doi: 10.1016/j.ecns.2020.07.002
-
Absolute eigenvalue diffusion tensor analysis for human brain maturation. Suzuki Y, Matsuzawa H, Kwee IL, Nakada T. NMR Biomed. 2003 Aug;16(5):257-60. DOI: 10.1002/nbm.848
-
Brain Developmental Abnormalities in Prader-Willi Syndrome Detected by Diffusion Tensor Imaging.Kenichi Yamada, Hitoshi Matsuzawa, Makoto Uchiyama, Ingrid L. Kwee and Tsutomu Nakada.Pediatrics August 2006, 118 (2) e4428; DOI: https://doi.org/10.1542/peds.2006-0637
-
Developmental abnormalities of the brain exposed to childhood maltreatment detected by diffusion tensor imaging. Yamada K, Suzuki Y, Okuyama M, Watanabe M, Nakada T. Neurol Res.2019 Jan;41(1): 19-25. doi: 10.1080/01616412.2018.
-
Maturational decrease of glutamate in the human cerebral cortex from childhood to young adulthood: a 1H-MR spectroscopy study. Shimizu M, Suzuki Y, Yamada K, Ueki S, Watanabe M, Igarashi H, Nakada T, Pediatric Research,2017 Nov;82(5):749-52. doi: 10.1038/pr.2017.101.
-
Slow accumulations of neural activities in multiple cortical regions precede self-initiation of movement: an event-related fMRI study. Sakata H, Itoh K, Suzuki Y, Nakamura K, Watanabe M, Igarashi H, Nakada T. eNEURO, 2017 Oct 30;4(5). doi: 10.1523/ENEURO.0183-17.2017
研究分野
- 統合脳機能研究センター





