(2018年7月26日公開)
担当:須貝章弘先生
所属:神経内科学分野
はじめに
脳のニューロンがゆっくり喪失していく神経変性疾患は、現代社会と人類が直面する克服すべき大きな課題です。多くの高齢者とその家族が苦しめられるアルツハイマー病をはじめとした認知症も、神経変性疾患に含まれます。これらの神経変性疾患は、ある特定の脳部位に蓄積する特定のタンパク質によって病理学的に特徴づけられています。神経内科の医師は、このような神経変性疾患を抱えた患者さんやその家族と毎日のように向き合っています。しかしながら、「なぜ私がこんな病気になってしまったのでしょう? どうすればこの病気を治せますか?」といった切実な質問には、残念ながらまだ正確には答えることはできていません。なぜある人に、これらの特定のタンパク質が異常に蓄積してしまうのか、その病態メカニズムについては分からないことがたくさんあるのです。
ここでは、神経変性疾患のなかでもTDP-43というタンパク質が異常に蓄積することによって特徴づけられる筋萎縮性側索硬化症(ALS)についての私たちの基礎的な研究の成果について紹介します。
筋萎縮性側索硬化症で蓄積するTDP-43
筋萎縮性側索硬化症では、運動ニューロンの障害により進行性の筋力低下が生じ、最終的には呼吸筋の筋力低下に至り生命の維持が困難になってきます。TDP-43はこの神経変性疾患の運動ニューロンの細胞質に凝集して蓄積します。さらに、TDP-43の遺伝子異常は、筋萎縮性側索硬化症の原因になります(Yokoseki et al, 2008)。したがって、TDP-43は、筋萎縮性側索硬化症の病態に直接的に関連している分子であるといえます。
TDP-43はRNAに結合するタンパク質であり、本来は細胞の核内で多くの仕事をしています。ここでは主に、遺伝子をもとにしてつくられるRNAにおきるスプライシングという現象を調節しています。ひとつの遺伝子が発現すると、RNAを介して、何らかの機能をもつタンパク質がつくられます。このとき、RNAのなかのイントロンという部位が切断され、残った部位がくっつきあうことにより、成熟したRNAがつくられます。このイントロンが切断される過程をスプライシングと呼んでいます。細胞内の環境に応じて、異なるスプライシングのパターンが起こり得ます。これによりひとつの遺伝子から複数の異なるRNAがつくられ、これらのRNAからそれぞれのタンパク質がつくられるのです。この細胞内の環境というのは、最終的には、スプライシングに関わってくるタンパク質の量や位置する場所が大きく影響します。TDP-43は、多くのRNAにおきるスプライシングに関わっていることが分かっています。したがって、細胞内のTDP-43の量が変化してしまうと、これらのスプライシングの調整が狂ってしまい、その細胞にとって適切なRNAがつくられなくなってしまうのです(Shiga et al, 2012; Ishihara et al, 2013)。
TDP-43の発現を調節する機構
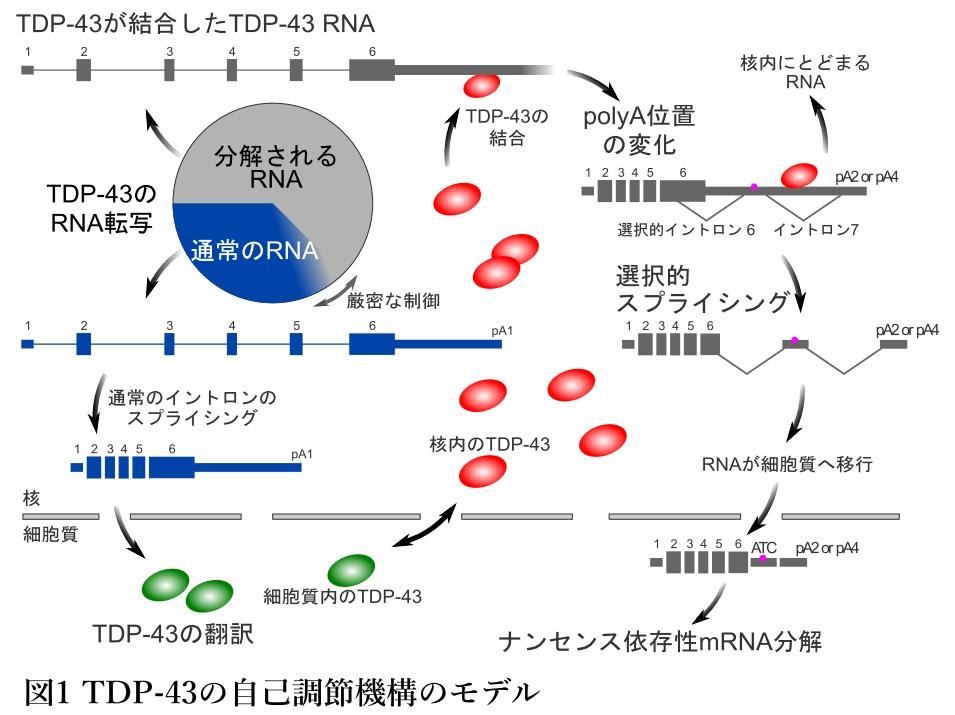
それでは、どのようにして、TDP-43の量はそれぞれの細胞で一定に保たれているのでしょうか。実は、とてもうまくできたことに、TDP-43は自分自身で自分の発現量を調節しています。TDP-43は、たくさんのRNAに結合するタンパク質ですが、自身をつくりだすもとになるRNAにも結合することが分かっていました。しかし、その後におこる自己調節の機構については、詳しくは分かっておりませんでした。私たちの研究の結果、核内のTDP-43の濃度に依存して、自身をうみだすRNAに結合することにより、このRNAの長さを変化させた後に、通常とは異なるスプライシングを起こさせることが明らかになりました(図1)。このような処理をうけたRNAは、速やかに細胞質にうつり、ここで迅速に分解されます。つまり、核内のTDP-43の濃度によって、細胞質におけるTDP-43をつくりだすもととなるRNAの量を絶妙に調節していたのです(Koyama et al, 2016)。
筋萎縮性側索硬化症におけるTDP-43のRNA動態の乱れ
筋萎縮性側索硬化症では、何らかの原因によって、本来は主に核に局在するTDP-43が、最終的には細胞質で凝集して蓄積します。このような運動ニューロンでは、核内のTDP-43が少なくなっています。自己調節のメカニズムは核内のTDP-43の濃度に依存しているため、細胞質ではTDP-43が蓄積しているにもかかわらず、TDP-43のもとになるRNAをさらに増やすように働いてしまっていることが予想されました。
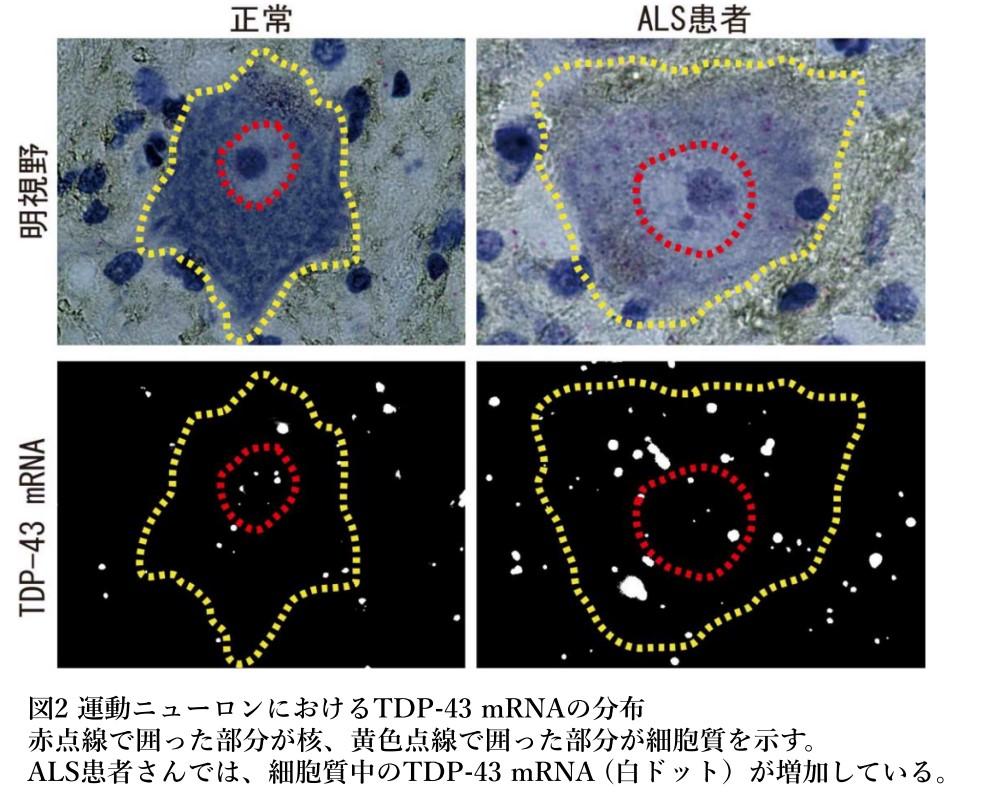
そこで実際に、筋萎縮性側索硬化症患者さんの脊髄の運動ニューロンを調べてみました。細胞中に存在するひとつひとつのTDP-43のRNAを検出する手法を駆使して調べた結果、運動ニューロンの細胞質ではTDP-43のRNAが増えていることが明らかになりました(図2)。この事実は、病気の最終ステージにおいてTDP-43が異常に蓄積しているときに、運動ニューロンはそれでもさらにTDP-43を生み出し続けているということを意味します。もともとTDP-43は凝集しやすい性質をもっていて、この凝集性は濃度に依存することが分かっています。筋萎縮性側索硬化症において障害される運動ニューロンは、TDP-43の異常な蓄積、凝集という意味において悪循環に陥ってしまっていると考えられます。すなわち、本来は、核内のTDP-43の量を厳密に調節するためにあった自己調節の機構が、病気のフェーズに入ってしまったばあいには、逆に、病気の進行を加速させる役割を演じてしまっているといえます(Koyama et al, 2016)。
ロバストネス(頑健性)と脆弱性のトレードオフ
本来は健康であるはずの私たちが病気になるということは、いったいどういうことなのでしょうか。TDP-43という分子レベルに掘り下げて考えたばあい、本来は核内の量が一定に保たれるはずが、筋萎縮性側索硬化症では、どうしてそのバランスがくずれて、最終的に凝集体をつくってしまうのでしょうか。
この問題の解釈モデルを作るために、私たちは、細胞内のTDP-43の動態について、コンピュータ上でモデル化してみました(Sugai et al, 2018)。このモデルでは、TDP-43の自己調節の機構は、細胞内で起こり得るさまざまな擾乱に対し、TDP-43の発現の量を一定に保ちやすくさせました。その一方で、いくつかの特殊な細胞内の擾乱に対しては、この頑健性(ロバストネス)は崩れ、逆に脆弱性が顕わになることが分かりました。このような細胞内の擾乱には、TDP-43の凝集性の亢進、TDP-43の核から細胞質への移行不良、断片化した異常TDP-43の分解効率の低下、そして自己調節機構そのものの効率の低下、がありました。これらの擾乱に対する脆弱性は、一般的な細胞内の擾乱に対する頑健性を強めれば強めるほど顕著になってくるという、トレードオフの関係がみられました。このトレードオフの関係の背後には、核内のTDP-43の量を一定に保つ自己調節のためのRNA転写の冗長性があることが分かりました。さらにこのモデルから、TDP-43の異常な蓄積という病的な状態は、RNA転写の冗長性を弱めてやることによって、正常な状態への復帰が可能であることが予想されました(図3)。
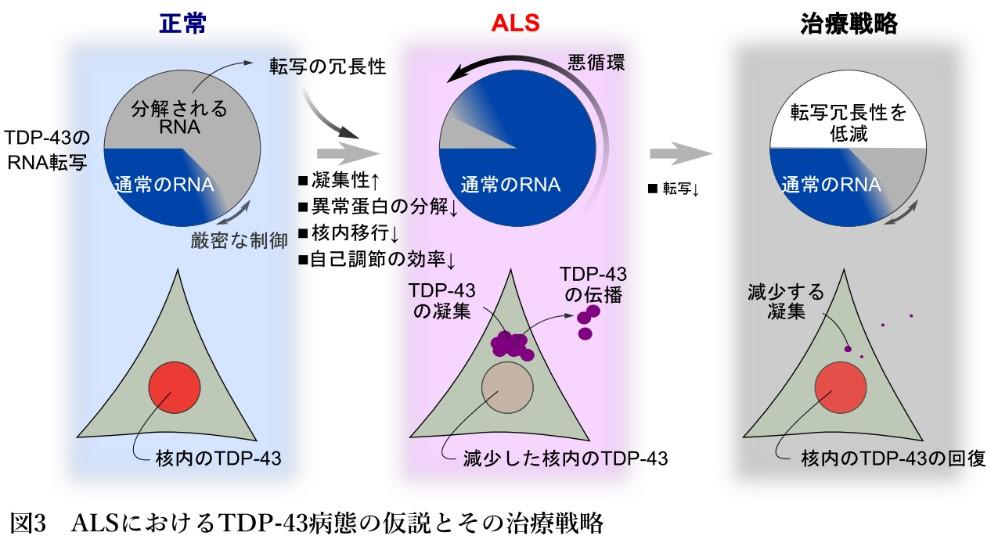
以上のような実験データの積み重ねと、そこから得られたコンピュータ上のモデルをもとに、私たちは、TDP-43が異常に蓄積してしまう病態として、ロバストネス(頑健性)と脆弱性のトレードオフによる病態仮説を提唱しています。このような疾患理解のうえに立つと、これまでのさまざまな事実が説明可能になります。今後は、これらの仮説をひとつひとつ検証していくことが求められます。





