(2018年1月4日公開)
担当:システム脳病態学分野
田井中一貴 特任教授
はじめに
脳内で起きる種々の神経活動と、それらに関連する様々な内在性分子の動態を包括的に解析することは神経科学分野における中心的な技術課題の一つである。これまでに脳をスライス切片に薄切りして、それぞれのスライスをイメージングし、それらのイメージデータを重ね合わせて3D再構成する切断面断層撮影法が開発されてきた。ところが、この手法では、一つの脳サンプルの3Dイメージを取得するために、かなりの時間・コストがかかるという問題がある。一方、包括的な全脳可視化技術としてMRIやPETなどのイメージング手法が確立されてきた。これらの手法は、ライブイメージングが可能という点で際立った特徴があるものの、レポータータンパク質や免疫組織化学などの細胞・分子標識技術と組み合わせて解析することは現時点では困難である。そこで、別の方法として脳組織を破壊せずに透明化して3Dイメージングする新たな手法に注目が集まっている。本コラムでは、CUBIC(Clear, Unobstructed Brain/Body Imaging Cocktails and Computational analysis)による脳組織透明化及び高速イメージング顕微鏡を用いたマウス全脳解析技術について紹介する。
1 マウス脳丸ごと透明化
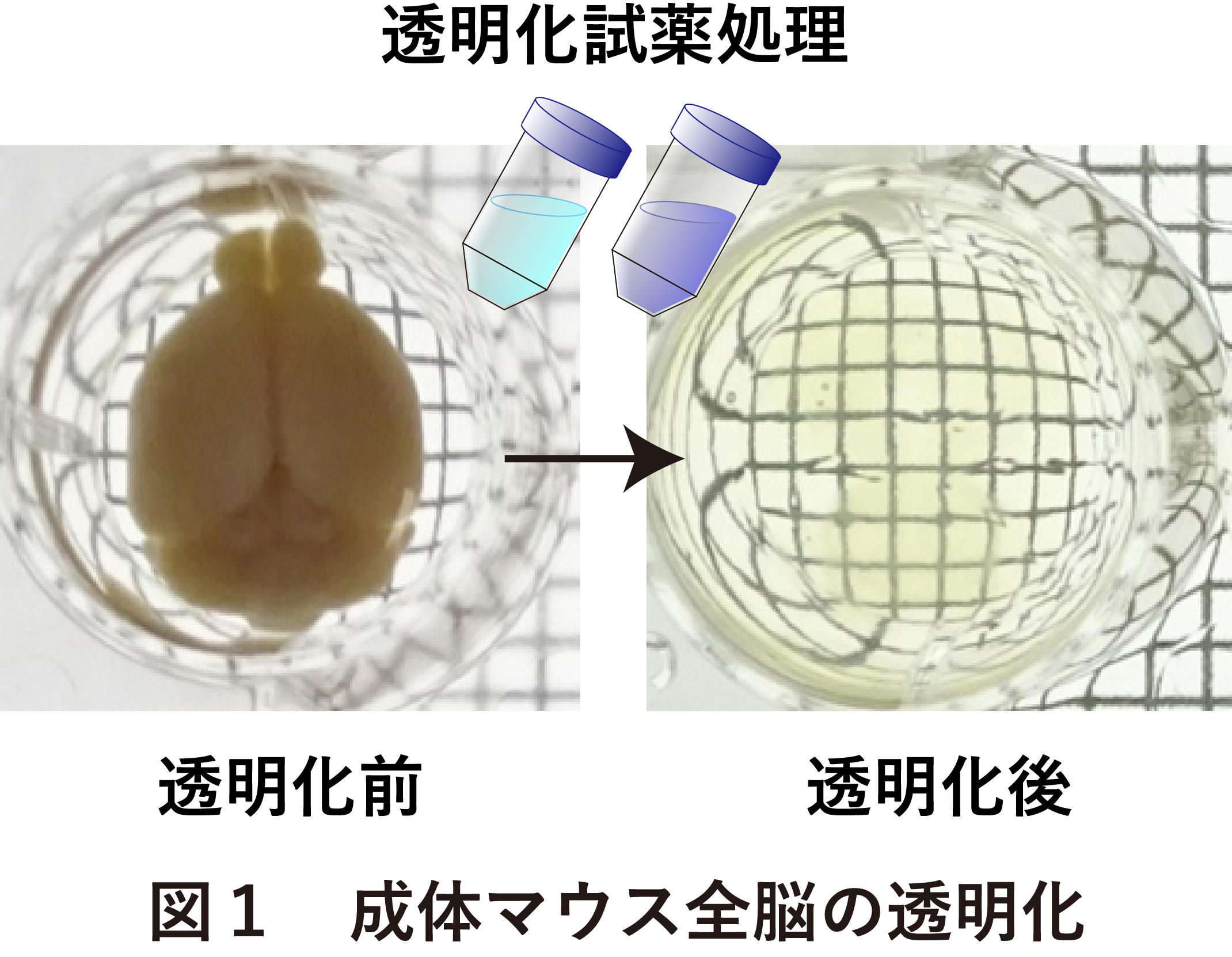
ここ数年膨大な種類の生体透明化技術が開発されてきたが、これらの手法に共通する原理について概説する。入射した光が散乱を起こさず物質を通過したときに、その物質は透明であるように見える。従って、光の散乱の原因となる因子を除去し、物質と周囲の媒体の屈折率を均一化することが、透明化するために必要となる。組織内の水は、タンパク質や脂質に比べて屈折率が大きく異なっているため、光散乱の主因となる。組織の透明化は、すなわち組織内の水を化学的に屈折率溶剤に置換する過程とも言える。脳の深部まで光の散乱を伴わずに高度に透明化するためには、高効率な組織内の水の置換を促すために脂質の高度な除去が必要となる。そこで、CUBICにおける透明化処理では、4%パラホルムアルデヒド水溶液で固定したマウス脳組織に対して、アミノアルコールの一種であるN-ブチルジエタノールアミンと界面活性剤であるTriton X-100との混合水溶液(脱脂液;CUBIC-L)で数日処理することにより、脳組織の高度な脱脂を実現する。また、脱脂処理後の脳組織をPBSで洗浄後、解熱薬の一種であるアンチピリンと水溶性ビタミンであるニコチンアミドの高濃度水溶液(屈折率調整剤:CUBIC-R)で二日間処理することで、脳組織が高度に透明化する(図1)。ケミカルプローブや免疫組織化学による各種標識技術については、現在開発中であるものの、脱脂処理後の脳組織に対して染色処理を行うことを基本とする。
2 高速・高解像度全脳イメージング
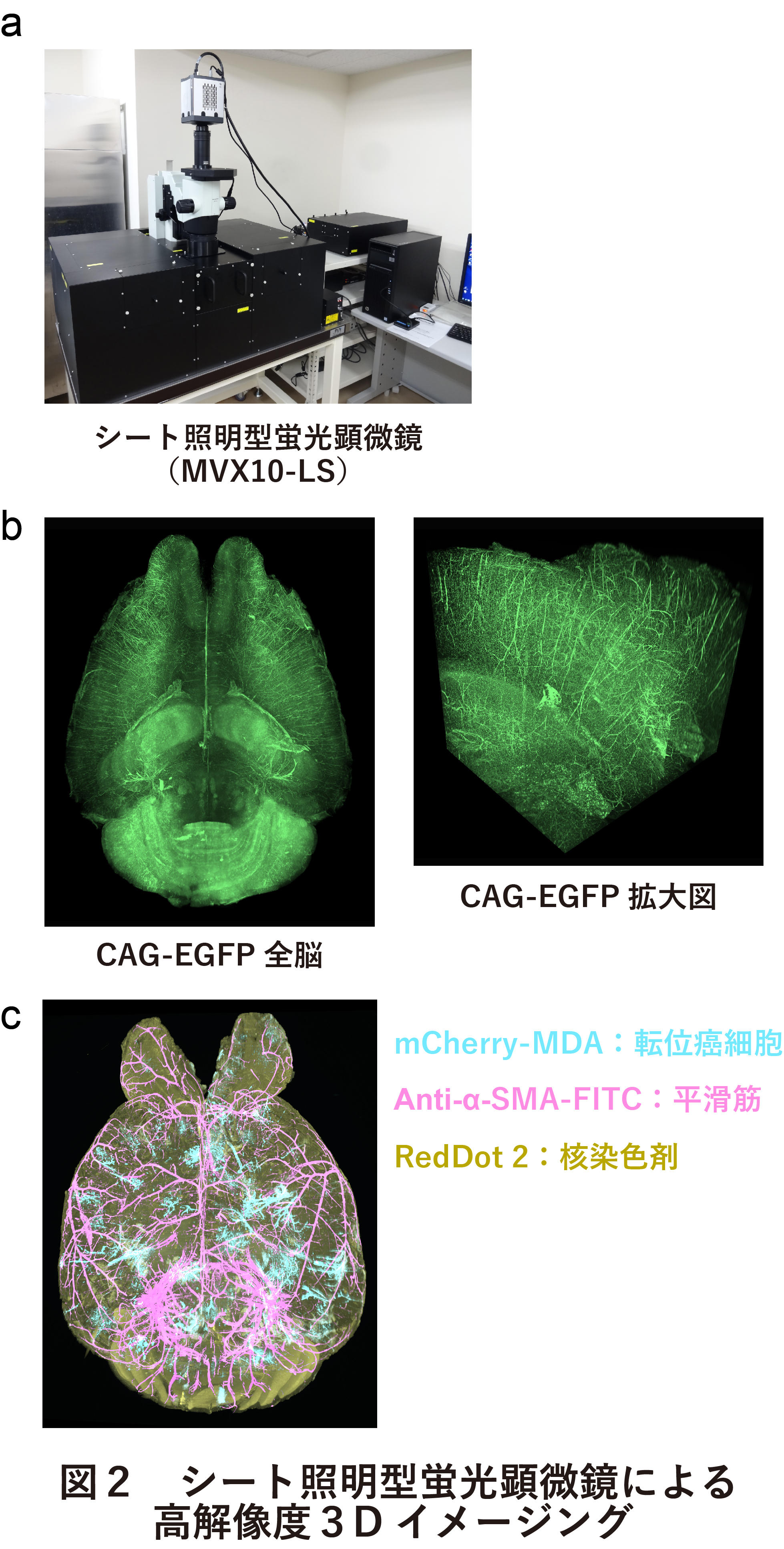
ハイスループットに全脳イメージングを達成するためには、透明化処理だけではなく、イメージングの高速化も必須の課題である。共焦点顕微鏡や二光子励起顕微鏡などによる「点」を撮像する手法では、脳全体の高解像度イメージ画像を取得するために少なくても一日以上は必要である。そこで、「点」ではなく「面」を撮像するシート照明顕微鏡(LSFM)に着目した(図2a)。LSFMでは、1つのマウス脳サンプルに対して、わずか1-2時間程度で高解像度な全脳イメージ画像を取得することができる。ただ、この顕微鏡を用いる場合、深部イメージングに適した二光子励起顕微鏡に比べて、組織全体が十分に透明になっていなければ鮮明な画像を取得することができないことに留意されたい。CUBICによる透明化手法とLSFMによる全脳イメージングにより取得したCAG-EGFPマウスの全脳イメージング画像を図に示す(図2b)。脳全域において、深部まで高解像度にレポータータンパク質のシグナルを高感度に検出することができる。また、本手法を用いたマルチカラーイメージングの応用例として、レポータータンパク質を発現するがん細胞を脳に転移させたマウスに対して、核染色剤および平滑筋特異的抗体により標識させた脳サンプルのイメージング画像を示す。(図2c)このように、CUBICにより蛍光タンパク質、ケミカルプローブ、抗体の3重標識のサンプルを全脳丸ごと観察することができる。
3 画像解析技術
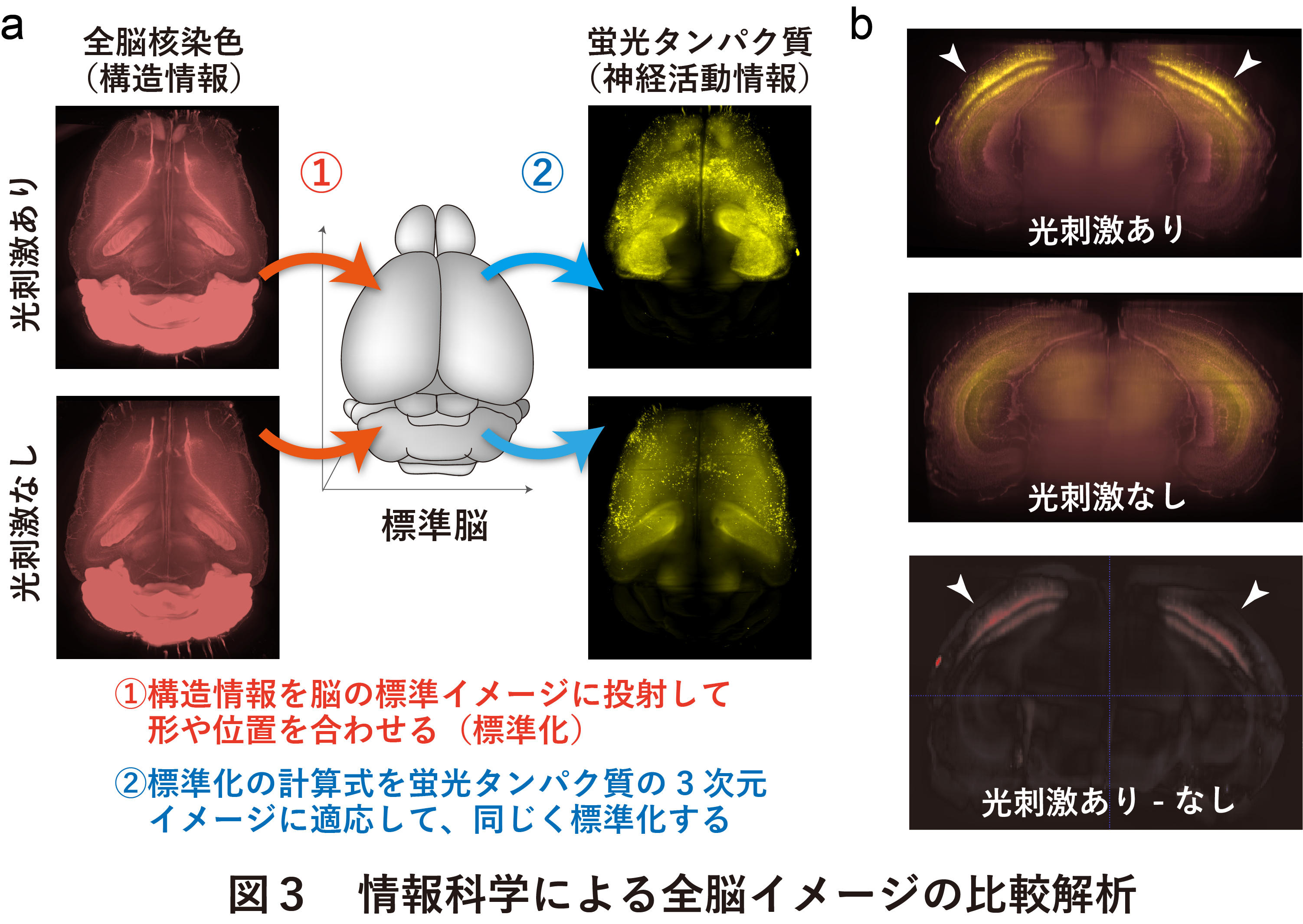
次に異なるサンプル間の遺伝子発現を定量的に比較するための画像解析技術について紹介する。核染色剤の蛍光シグナルから得られる3D全脳イメージは脳全体の解剖学的情報を与えるため、観察されるシグナルの解剖学的な位置情報が正確に決定できる。さらに、脳全体の解剖学的情報はサンプル間で共通な情報であり、referenceとなる脳イメージ(MRIで撮影された全脳イメージなど)に投射して標準化し、サンプル間のシグナルを比較するための情報科学的な解析に使用できる。神経活動に応じて遺伝子発現が誘導されるArc遺伝子の下流にdVenusをコードした変異マウスを用いて、脳全体の神経活動が光刺激によってどのように変化しているかを調べた。暗闇の中で2日間飼育した後、急に光を当てたマウスと当てていないマウスの脳の3次元画像を取得した(図3 a)。両者のdVenusの蛍光シグナルを差し引くことで、光によって活動する脳領域を全脳レベルで網羅的に同定することに成功した(図3b)。
おわりに
近年の組織透明化技術の進歩により全脳の細胞の働きを1細胞解像度で包括的に観察できる技術基盤が整いつつある。深部まで均一に染色可能な免疫組織化学技術や各種レポーターマウス作製技術、ウィルスによる特異的神経標識手法と組み合わせることで、システム科学的なアプローチによる脳機能解析が飛躍的に進展することが予想される。マウス脳に限らず、ヒト脳においても同様の技術基盤が確立されることにより、トランスレータブルな病態解析の実現が期待できる。





