新潟大学脳研究所神経内科 下畑 享良
はじめに
脳梗塞に対する血栓溶解療法後に生じる脳出血の合併を防止する新しい治療についてご説明致します.今回のレクチャーでは,まず血栓溶解療法後に生じる脳出血の機序についてご説明します.つぎにこの脳出血合併症を予防する治療薬の開発をめざして私どもが行った研究を,動物モデル,治療標的分子の同定,そして最後に新規治療法の効果に分けて,順にご説明致します.
1.血栓溶解療法後に生じる脳出血の機序
まず脳梗塞と血栓溶解療法についてご説明いたします.脳梗塞は,脳の動脈が血栓により閉塞することにより発症します.よってこの血栓を溶かし,脳血流を再開することができれば脳梗塞による症状が改善するのではないか?という考えから始まった治療が「血栓溶解療法」です.そしてこの治療に使用する薬剤が,組織型プラスミノゲン・アクチベーター(t-PA)です.日本では平成17年10月に承認を受け,使用することができるようになりました.
このtPAは非常に有用性の高い薬剤ですが,現状では全脳梗塞患者の5%未満しかtPAによる治療による恩恵を受けておりません.この原因としては,tPAは発症から3時間以内の脳梗塞患者にしか適応がないためです.この理由は一定時間を超えてtPAを使用すると脳出血を合併する頻度が高くなるためです(図1).これは血管閉塞とtPAにより血液脳関門が破綻するためと考えられています.
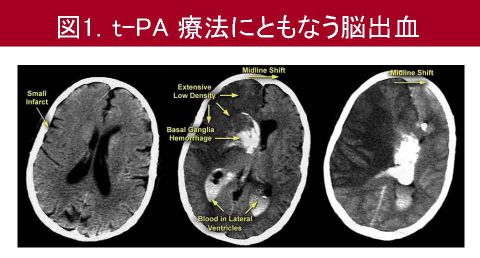
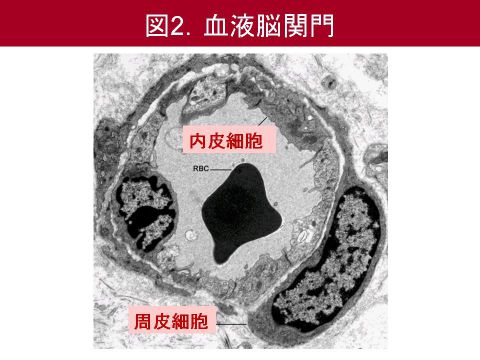
血液脳関門は内皮細胞,周皮細胞,アストロサイト,そしてそれらを取り囲むタイプIVコラーゲンなどの細胞外マトリックスなどから構成されています(図2).tPA療法後の脳出血のメカニズムとしては,脳梗塞後に活性化されるタンパク分解酵素であるマトリックスプロテアーゼ9(MMP9)等による細胞外マトリックスの分解や,血管内皮細胞や周皮細胞の障害が考えられます.以上を踏まえ,我々は,tPA療法後の脳出血を抑制する血管保護薬を同定する必要があると考えました.
2.脳出血合併症を予防する治療薬の開発
次に私どもが行なったtPA療法後の脳出血を予防する薬剤を開発する戦略について示します. まず,人の脳梗塞にみられるtPA治療後の脳出血を再現する動物モデルを使用します.つぎにこのモデルを使用して,tPA治療後に血管に発現し,MMP9を誘導する標的分子を同定します. そしてこの標的分子を除去する薬剤が,血管を保護しうるかどうか検討するというものです.
1)動物モデルについて
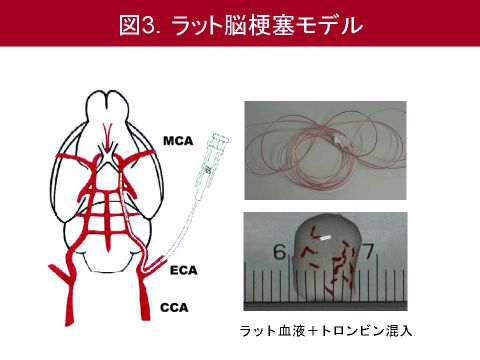
まず動物モデルについて説明します.日本医大より2007年に報告されたラット脳塞栓モデルを使用しました.これはラット血液にトロンビンを混入し作成した自家血血栓をカテーテルから中大脳動脈に注入し,閉塞させる局所脳虚血モデルです(図3).そして超音波にて脳表血流が血管閉塞前の50%未満に低下したラットのみ使用し,血管閉塞の1時間後ないし4時間後にt-PAを静脈投与いたしました.
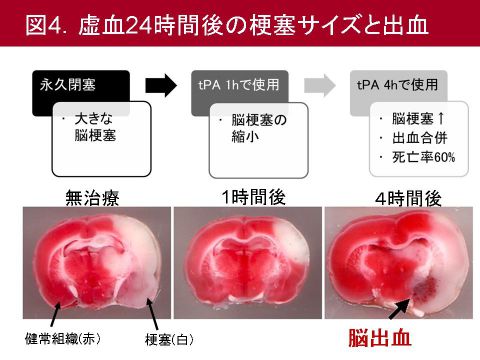
結果ですが,tPAを投与しない永久閉塞群では中大脳動脈領域に大きな脳梗塞を認めます.これに対し,血管閉塞1時間後にtPAを投与した群では梗塞サイズは顕著に縮小します.tPAを4時間で投与した群では,脳梗塞サイズはむしろ拡大し,肉眼的に脳出血が脳梗塞の周辺部分に認められるようになります.死亡率も前者2群が10%台であったものが,tPAを4時間で投与した群では60%程度まで増加しました
(図4).
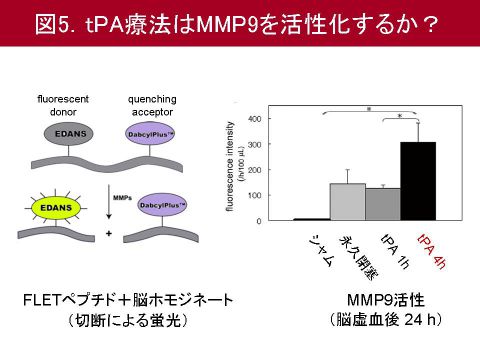
次に本モデルにおける脳出血のメカニズムを検討するため,切断により蛍光を発するFLETペプチドを用いて作成したMMP9の基質と脳ホモジネートを反応させMMP9活性の定量を行いました.この結果,tPAを4時間で使用した群では有意に高度のMMP9の活性化が生じていることが分かりました(図5).さらにtPAを4時間で投与した群で認められたMMP9の高度の活性化は,脳血管を構成する細胞外マトリックスであるタイプIVコラーゲンを分解してしまうことが分かりました.以上より,ラット脳塞栓モデルは,tPA療法後の脳出血に対する血管保護薬の検討に適したモデルと考えられました.
2)治療標的分子としてのVEGFの同定
つぎに治療標的分子の同定に移ります.今ほどご説明したモデルを用いて,種々の候補蛋白についての検討を行いましたが,その中で血管内皮細胞増殖因子(VEGF)が脳梗塞周辺に強く発現することがわかり,脳出血と関連する可能性が示唆されましたので,さらに検討を行いました.
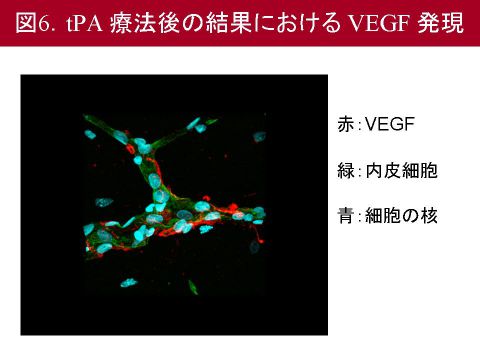
まずVEGFの発現を調べるため免疫染色を行いました.血管閉塞を行わないシャム手術ではVEGFの発現は認められませんが,血管閉塞を行うと脳血管にVEGFが発現するようになり,とくにtPAを4時間で投与した群において強く発現していました(図6).さらにVEGFの発現部位を二重染色により検討しましたが,VEGFは血管内皮細胞,周皮細胞,アストロサイトに発現していました.一方,VEGFが結合し活性化されたと考えられるリン酸化VEGF受容体は周皮細胞においてのみ発現が認められました.
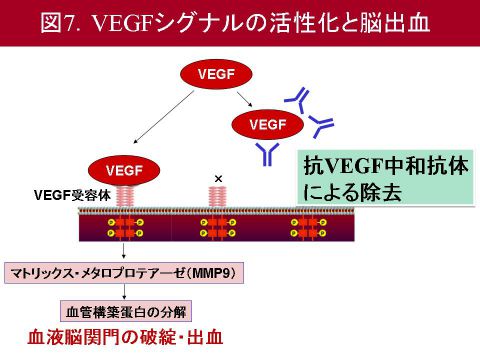
以上をまとめます.治療可能時間を超えたtPA療法は,血液脳関門におけるVEGFシグナルの活性化を介して,MMP9の活性化を引き起こし,その結果,血管構成蛋白が分解され血液脳関門の破綻を引き起こす可能性が示唆されました(図7).
3)血管保護療法としてのVEGF抑制療法
次にVEGFシグナルの抑制が脳出血の防止に有効であるか検討を行いました.VEGFシグナル抑制の方法としては,抗VEGF中和抗体によるVEGFの除去,ならびにVEGF受容体の活性化を抑制するVEGF受容体阻害剤の使用を考えました.
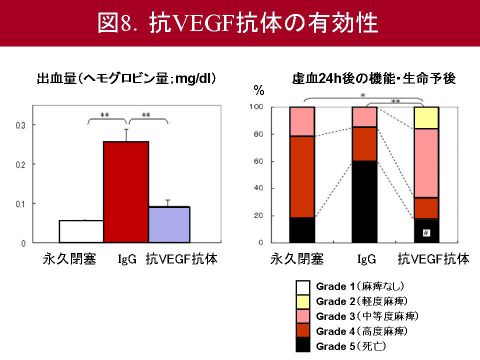
まずラットVEGFを中和する抗体としてRB-222を同定しました. さきほどtPAを4時間で投与した群におけるMMP9の高度の活性化を示しましたが,RB-222は,このMMP9の活性化を抑制しました.この結果,RB-222は血管を構成する細胞外マトリックスであるtype IV collagenの分解を抑制しました.
さらにRB-222がtPA療法後の脳出血量を抑制できるか検討しました.脳出血は脳単位体積当たりのヘモグロビン量として計測しました.RB-222はコントロール抗体の投与と比較して有意に脳出血を抑制し,さらに機能予後・生命予後も有意に改善しました.具体的にはtPAを4時間で投与したラットに対し,コントロール抗体を投与すると24時間後ではその60%が死亡していたものが,RB-222を投与すると死亡率は20%弱まで減少しました.また同様の脳出血抑制効果は,VEGF受容体の活性化を阻害するSU1498の腹腔内投与でもみとめられました(図8).以上より,VEGFシグナルの抑制は,tPA療法に伴う脳出血に対して有効な治療戦略となる可能性が示唆されました.
最後にVEGF抑制療法の注意点および治療のタイミングについて説明いたします.VEGFは脳梗塞の亜急性期から修復期においては血管新生やリモデリングに関わり,脳梗塞からの回復に有利に働くものと考えられています.しかし今回の私どもの検討の結果から,超急性期から急性期においては,血液脳関門の破綻を引き起こし,脳出血の原因になる可能性が示唆されました.よって脳出血を抑制するためのVEGF抑制療法は超急性期から急性期に限ってのみ行う必要があると考えられました.
以上,VEGF シグナル阻害はtPAによる血栓溶解療法後の脳出血抑制に有望な治療戦略である可能性を示しました.今後,ヒトにおける臨床試験を目指してさらに研究を進めてまいりたいと考えております.





