(2018年3月1日公開)
担当:松井秀彰先生
所属:脳病態解析分野
はじめに
医療や衛生の進歩により人類の寿命が延びた今、加齢とともに発症する神経変性疾患、アルツハイマー病やパーキンソン病は、そのケアや病態解明が大きな問題となっている。ここでは未だに原因が不明で根本的な治療に欠けるパーキンソン病の、その研究の歴史を振り返りながら、今後の課題を考えてみる。
1.臨床や病理からの疾患の確立

(図1)AN ESSAY ON THE SHAKING PALSYの1ページ目(Wikipediaより)

(図2)Jean-Martin Charcotの写真(Wikipediaより)
病気というのはまず分類や定義がされ、その概念が確立しないと、研究することも診断することも難しいし、ましてや治療にははるかに至らない。パーキンソン病が最初に記載されたのは1817年、イギリスのJames Parkinson医師によるエッセイ集「AN ESSAY ON THE SHAKING PALSY」であると言われる(図1)。Parkinson医師は開業医であるが、実は自身の患者さんを診て記載したわけではなく、まちなかを観察し、寡動、前傾姿勢や、ふるえ=振戦に特徴がある人々を記録に残した。1888年にフランスの神経(内)科学の大巨人であるJean-Martin Charcotにより遅ればせながらParkinson医師の仕事が評価され、この「SHAKING PALSY」は「パーキンソン病」となった(図2)。1912年Friedrich Heinrich Lewyは、このパーキンソン病の病理の目印と言えるレビー小体を発見し、1919年ロシアのKonstantin Tretiakoffが博士論文においてパーキンソン病における中脳黒質の神経脱落を記載した。両者ともに20代後半の若さでの歴史に残る業績である1。他にも重要な仕事はたくさんあるが、それらはノーベル賞を受賞するスウェーデンのArvid CarlssonらによるL-dopaの発見につながる2。
L-dopaは中枢神経におけるドパミンの不足を補い、パーキンソン病における運動症状の多くを劇的に改善し、明らかに患者さんに貢献しているすばらしい薬剤である。しかしあくまで補充療法であり、年余を経てその効果は減少し、ジスキネジアやウェアリングオフなどの副作用にも悩まされることになる。L-dopa、他の薬剤、あるいは外科手術を含めた他の治療法には現在のところ疾患を抑止するという十分なエビデンスは残念ながらない。そのためやはりパーキンソン病の病態の理解、そして原因からの治療が望まれている。
現在では臨床からの知見に加えて、遺伝学的な解析も進み、パーキンソン病に関連する遺伝子の情報や患者さんの病歴に関する情報も増えてきている。例えばパーキンソン病になりやすい遺伝子変異などは次々と同定されているし、中脳黒質以外にも疾患に罹患しやすい部位もわかってきた。次項以降はそれらの知見を、どのように基礎研究が利用し、病態解明につなげようとしているかを考える。
2.哺乳類モデルからの知見
1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)は麻薬中毒患者さんが接種し、パーキンソン病様の症状を示した事がきっかけに見いだされた3。このMPTPとまた別のロテノンという毒物の両者は現在でも様々なパーキンソン病のモデル動物の作製に用いられる。MPTPおよびロテノンにはミトコンドリア機能を阻害する作用があり、パーキンソン病の原因はミトコンドリア異常にあるのではないかという仮説は現在でも有力である。
MPTPの場合は、偶然にもその麻薬中毒患者さんがその毒性の機序解明の端緒になってしまったが、それ以外の毒物や薬物の効果は通常はモデル動物を用いて検証されることが多い。MPTPおよびロテノンはマウス、ラット、サルなど様々な哺乳類モデルでパーキンソン病に類似した神経脱落、つまり中脳黒質のドパミン神経の減少を模すことができる。投与方法によっては先に記載したレビー小体に類似した構造を再現することも可能である。
哺乳類モデルは医学研究の歴史の中で最もたくさん用いられたために、そこからの知見を全てここであげることは難しいのだが、その中の一つとして大脳基底核の生理学的な知見およびそれに引き続くパーキンソン病の外科療法の発展をあげてみる。大脳基底核は終脳の基底部にある大きな神経核群で、定義にもよるが、尾状核、被殻、淡蒼球、扁桃体および視床下核、黒質が含まれる。基底核は大脳皮質と視床の間に位置し、大脳皮質からの入力を受けてそれを処理し、再度そのシグナルを視床、大脳皮質へと送るループを形成している。ちょうど小脳と似たような立ち位置である。基底核は運動機能に関与し(もちろん他にも機能はあるが)、運動の発現や制御に関わっていると考えられている。
基底核群がなす神経ネットワークについては当研究所の笹岡教授のコラムにある報告を含め、様々な研究が行われてきた。ここでは治療につながった一例をあげる。先も述べたがMPTPは様々な実験動物に投与することでパーキンソン病に似た神経細胞死と運動障害を再現することができる。Mahlon DeLongらはMPTPを投与されたサルの大脳基底核の電気生理学的解析を行った結果、視床下核が異常興奮していることを見いだした。さらにこの視床下核を破壊すると、そのサルの運動障害を改善した4。それまで様々な部位において深部脳刺激(DBS)を試みていたAlim Benabidらは、そのDBSを視床下核に適用したところ、パーキンソン病の運動症状が劇的に改善することが見いだされた5。この視床下核をターゲットとしたDBSは現在でもパーキンソン病の治療に用いられている。
3.ハエモデルおよび培養細胞からの知見
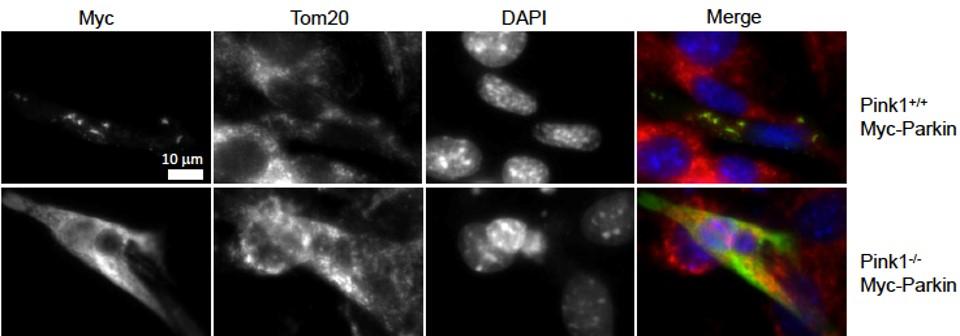
(図3)
(上段)PINK1の存在下ではCCCP処理によってParkin(緑)はミトコンドリア(赤)に集積する。
(下段)一方でPINK1がない場合、CCCP処理をしてもParkinは細胞質に広がったままである。
(Matsui H, et al. Hum Mol Genet.15;22:2423-2434,2013)
パーキンソン病の病態を研究するのには様々な研究対象が用いられており、その一例としてショウジョウバエと培養細胞を用いた非常にエレガントな研究結果をあげる。パーキンソン病はその大半が孤発性と言って遺伝性はないが、5~10%に家族性のものがあり、原因遺伝子の研究が進んでいる。その遺伝子産物の中にPINK1とParkinというタンパク質がある(以下一般向けの文章でもありPINK1とParkinはヒトに準じた記載方法で進める)。2006年に3つの研究グループがショウジョウバエを用いてほぼ同時に発表したのが、PINK1とParkinはPINK1が上流でParkinがその下流でミトコンドリア機能の維持に働いているという結果である6~8。これはPINK1がないハエとParkinがないハエと両者ともにないハエが類似のミトコンドリア機能異常を呈し、なおかつPINK1がないハエにParkinを過剰発現するとその異常が改善するが、ParkinがないハエにPINK1を過剰発現しても改善しないという実験結果から得られた考察である。
この研究ではPINK1とParkinが何をしているかの詳細は不明であったが、その後Richard YouleらがPINK1が異常なミトコンドリアにParkinをつれてくること、その結果そのミトコンドリアがミトファジーという機構により分解されることが明らかにされた9,10(図3)。これをきっかけにパーキンソン病の研究だけでなくミトファジーの研究も進んだ。これらはショウジョウバエや培養細胞といった研究対象が使い方や研究目的によってはとても役立つことを示している。
4.今後について
紙面の都合で、他の事柄については次回以降に触れることとし、ひとまず今後の展開を考えてみる。パーキンソン病は研究者も多く、その研究の歴史も200年に及ぶにもかかわらず、未だ原因の明らかでない難病と言ってよいだろう。iPS等で再生医療が可能になったと仮定しても、それではとても十分ではないだろう。というのも以前から細胞移植を行った健康であったはずの細胞もパーキンソン病の病理におかされることがわかっているからである。
もちろんそれでも有効な補充療法や対症療法があるので悲観するものではなくなったことは大きな進歩である。上記にあげさせていただいた様々な先人の研究成果はそれぞれがまさに偉業であることは疑いようもない。数々の偉業を持ってしても未だ壁のように立ちふさがるのがパーキンソン病という病であり、神経変性疾患である。医師や研究者は様々な研究手法や研究対象を総動員して、この疾患の解明にあたらなければ、全容の解明は難しいことは想像に難くない。近年では核酸やタンパク質の網羅的な解析、一細胞レベルの解析手法、分解能の高いイメージング技術等も進展しているが、そういった最新の手法に加えて、様々なこれまでの知見や仮説を統合するアイデアも要求される。次にこの壁に穴をあけるのはどのようなブレークスルーなのであろうか。





