私たちはこれまで主にメダカやゼブラフィッシュを用いて薬物の添加や遺伝子改変により様々なパーキンソン病モデルを作製してきました。それらはパーキンソン病の病態の理解に役立ってきましたが、患者さんの大部分を占める孤発性パーキンソン病の病態を模すモデル動物の作製はやはり困難でした。
We have created various models of Parkinson's disease by adding drugs or
genetic modification, mainly using medaka and zebrafish. Although these
models have been useful for understanding the pathogenesis of Parkinson's
disease, it has been difficult to create animal models that mimic the pathogenesis
of idiopathic Parkinson's disease, which accounts for the majority of patients.
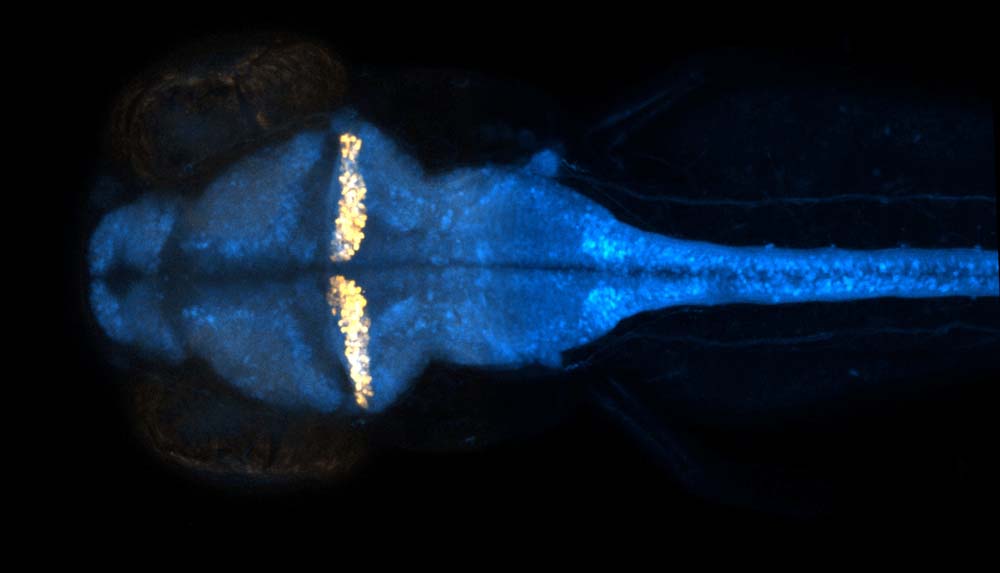
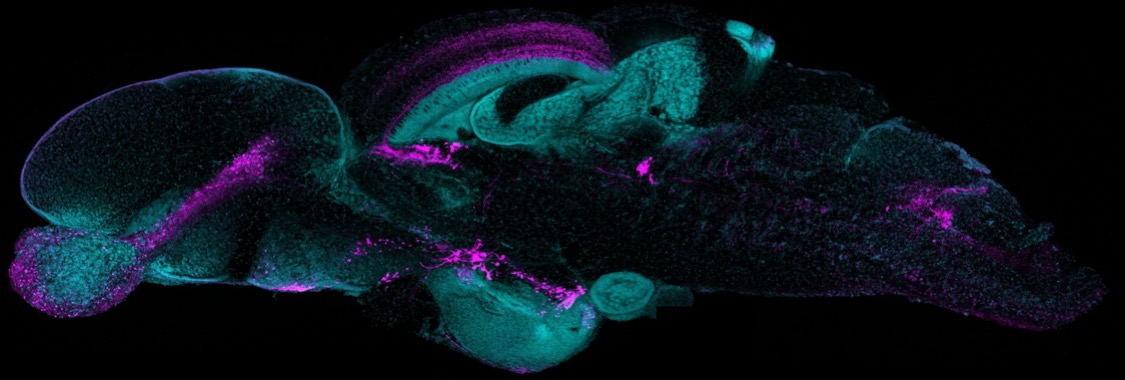 小型魚類の脳のドパミン神経、ノルアドレナリン神経です。左が吻側、右が尾側の脳にです。どれが大脳かわかりますか?
小型魚類の脳のドパミン神経、ノルアドレナリン神経です。左が吻側、右が尾側の脳にです。どれが大脳かわかりますか?These are dopaminergic and noradrenergic neurons in the brains of small
fishes. On the left is the rostral side and on the right is the caudal
side of the brain. Can you tell which one is the cerebrum?
ところで魚には様々な利点がありますが、その一つに魚類が多種多様であるということが挙げられます。アフリカのモザンビークには短い雨季の間にだけできる水たまりがあります。その水たまりは乾季には乾燥してしまいます。しかしそこに短い雨季の間だけ魚がいます。彼らはどんなに長生きしたくても、水がなくなれば死んでしまいます。乾燥に強い卵を土の中に埋め、それが雨季に孵化することで種として存続してきました。そのため長生きの形質が選択されず、脊椎動物の中で最も(あるいは2番目に)短命です。
Fish, by the way, have many advantages, one of which is the great variety
of fish species. In Mozambique, Africa, there are puddles of water that
form only during the short rainy season. These puddles dry up during the
dry season. But there are fish there only during the short rainy season.
No matter how long they want to live, they will die if there is no water.
They have been able to survive as a species by burying their drought-resistant
eggs in the soil, which hatch during the rainy season. As a result, they
have not been selected for long-lived traits and are the shortest (or second
shortest) of all vertebrates.
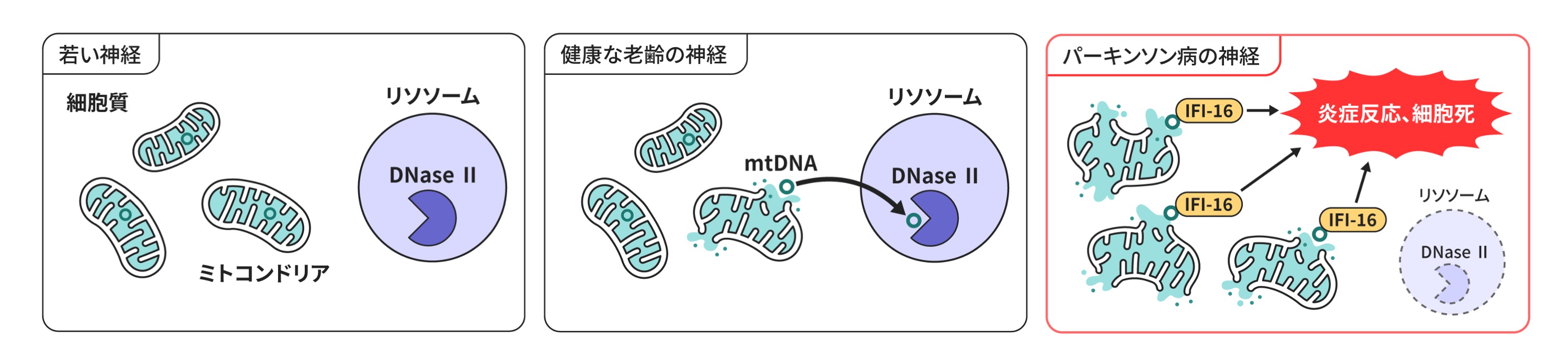
私たちはパーキンソン病などの加齢依存性の疾患は背景に老化があることで発症しやすくなると考えました。そこでこのアフリカメダカを解析したところ、加齢のみでドパミン神経の変性、αシヌクレインの蓄積といったヒトパーキンソン病に類似の表現型を呈することがわかりました
(Matsui et al., Cell Rep, 2019)。またこの魚の脳と、人の脳のαシヌクレインの翻訳後修飾を詳細に解析した結果、パーキンソン病におけるαシヌクレインの神経毒性に関係すると考えられるT64リン酸化の存在を報告しました。また、このT64リン酸化はαシヌクレインのoligomer形成に異常をきたし毒性を発揮することを明らかにしています
(Matsui et al., Proc Natl Acad Sci USA, 2023)。
We thought that age-dependent diseases, such as Parkinson's disease, would
be more likely to develop due to the presence of aging in the background.
When we analyzed the African killifish, we found that it exhibited phenotypes
similar to human Parkinson's disease, such as degeneration of dopaminergic
neurons and accumulation of alpha-synuclein, due to aging alone (Matsuiet al., Cell Rep, 2019). In addition, detailed analysis of post-translational modifications
of α-synuclein in fish brain and human brain revealed the presence of T64
phosphorylation, which is thought to be related to the neurotoxicity of
α-synuclein in Parkinson's disease. We have also shown that this T64 phosphorylation
causes abnormal oligomer formation of α-synuclein, resulting in toxicity
(Matsui et al., Proc Natl Acad Sci USA, 2023).
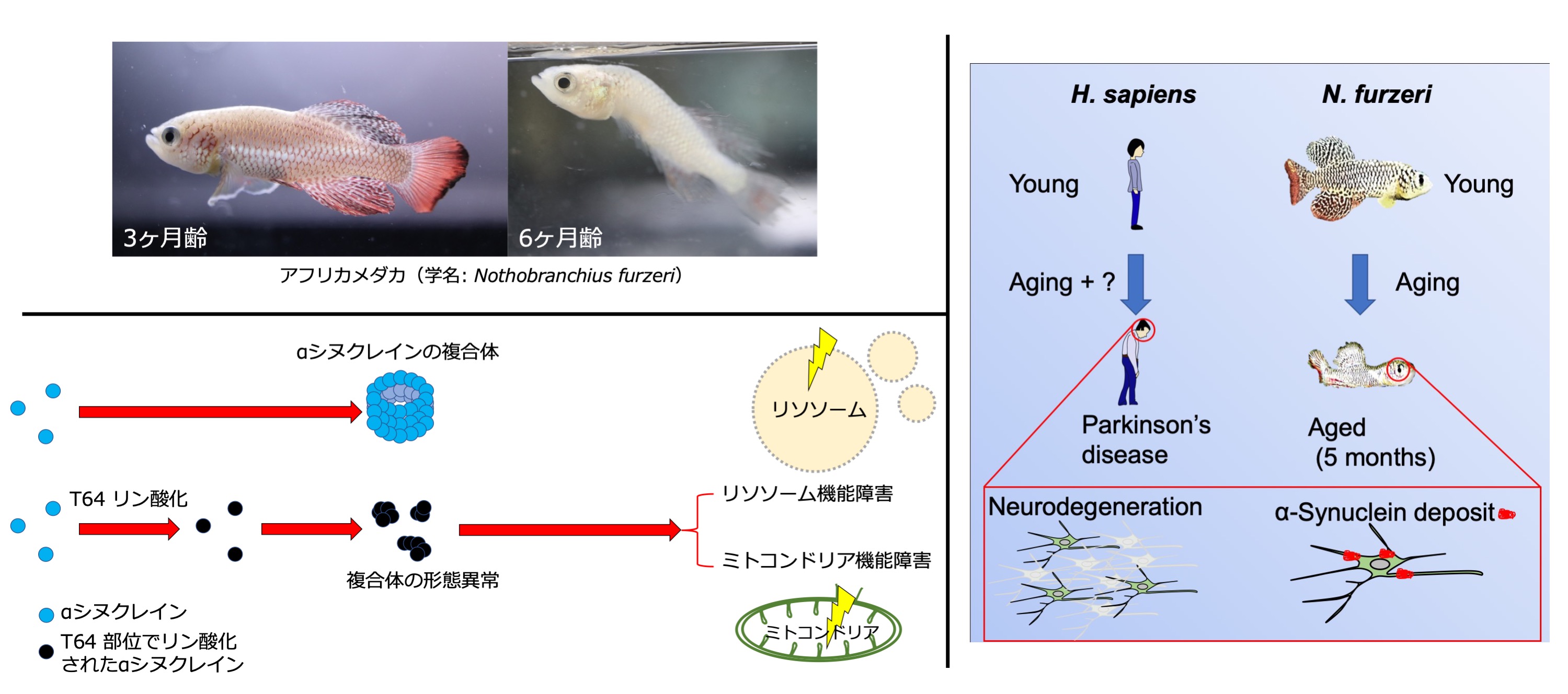
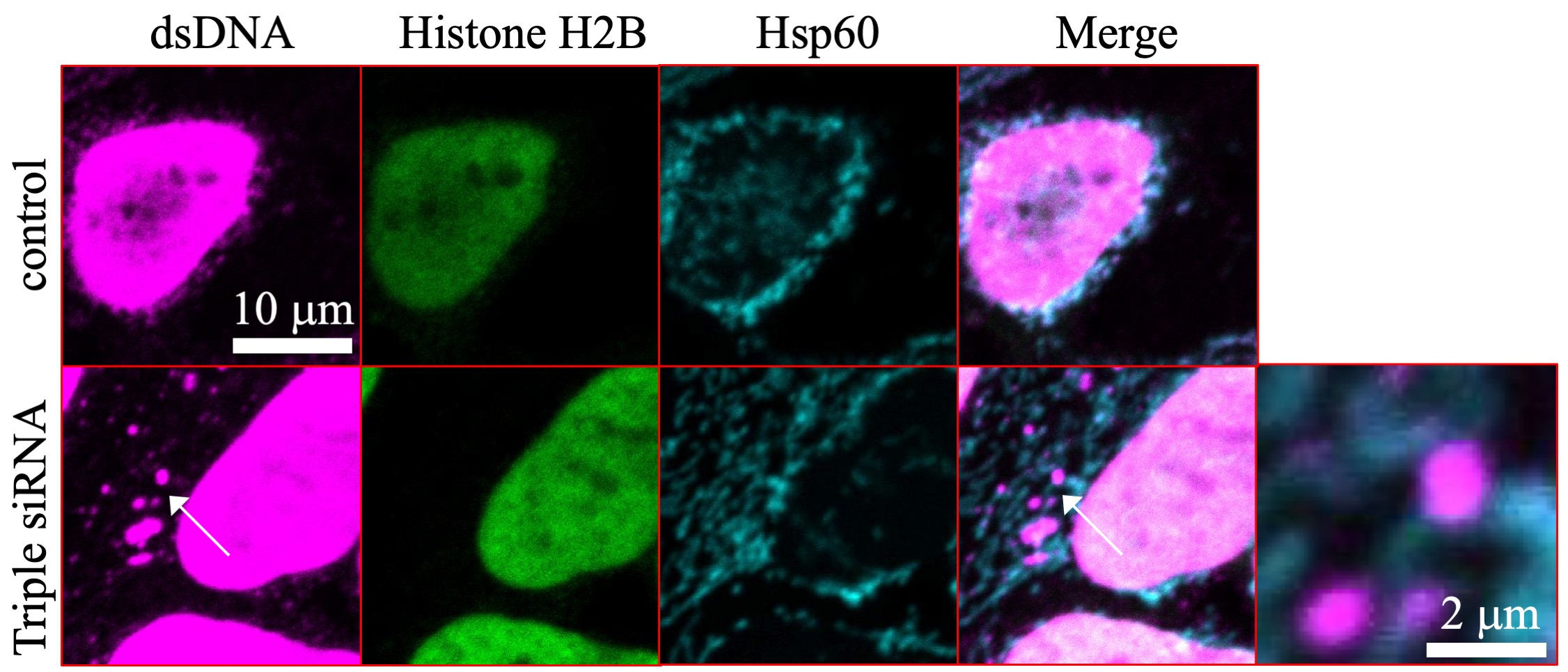
アフリカメダカは5カ月程度の加齢とともに、ドパミン神経の変性やαシヌクレインの蓄積といったヒトのパーキンソン病に類似した病理変化をきたします。
αシヌクレインがT64部位でリン酸化をされることにより、αシヌクレインのT64リン酸化が異常な複合体の形成につながり、結果リソソーム機能障害やミトコンドリア機能障害、ひいては細胞毒性や神経細胞死につながると考えられる。
African killifish develop pathological changes similar to Parkinson's disease
in humans, such as degeneration of dopaminergic neurons and accumulation
of alpha-synuclein, with aging of about 5 months. The T64 phosphorylation
of α-synuclein can lead to the formation of abnormal oligomer complexes,
resulting in lysosomal dysfunction, mitochondrial dysfunction, and ultimately
cytotoxicity and neuronal cell death.