(2020年7月20日公開)
担当:阿部学先生
所属:モデル動物開発分野
関連コラム
脳の働きを分子から考える
脳の働きを分子から考える その2 〜遺伝子改変動物開発技術の発展
はじめに
脳機能は多数の神経細胞がシナプスを介してつながった神経回路によって生み出されます。神経回路は発生初期には未成熟であり過剰なシナプスを形成していますが、成長過程において不要なシナプスを除去することで成熟した神経回路が完成することが知られています。また、中枢神経系におけるシナプス形成と維持の制御は、記憶・学習の素過程であるシナプス可塑性や神経・精神疾患とも深い関係があると考えられています。近年、その全体像が明らかになりつつあるシナプス形成の分子機序において、新潟大学脳研究所で発見されたデルタ型グルタミン酸受容体が重要な役割を果たしていることを紹介致します。
グルタミン酸受容体のクローニング
中枢神経系において速い興奮性シナプス伝達を担うイオン透過型グルタミン酸受容体チャネルは、生理学、薬理学的研究による証拠の積み重ねから、その存在が予見された当初よりNMDA型、AMPA型(= キスカル酸型)、カイニン酸型の3つのタイプに分けられる事が示されていました。1980年代後半より、分子生物学的手法を用いて受容体チャネルを構成するサブユニットの遺伝子が世界中のラボから次々とクローニングされ、NMDA型受容体では7種類(GluN1、GluN2A~D、GluN3A, 3B)、AMPA型受容体では4種類(GluA1~4)、カイニン酸型受容体では5種類(GluK1~5)のサブユニットからなる複合体が、その予測通りの特性を有するイオンチャネルを構成することが明らかとなっています1.。1990年に新潟大学脳研究所薬理学分野に赴任した三品昌美教授(後に東京大学医学部教授を経て現立命館大学教授)と﨑村建司助教授(後に新潟大学脳研究所細胞神経生物学分野教授)らのグループは、NMDA型受容体の分子実体を明らかにして記憶・学習との関わりを調べることを研究目標として掲げ、マウスのグルタミン酸受容体チャネルサブユニット遺伝子のほぼ全てをクローニングし、アミノ酸配列の相同性からGluRα1~4(= GluA1~4)、GluRβ1~3, γ1, γ2(= GluK1~5)、GluRε1~4, ζ1(= GluN2A~D, GluN1)と名付けました。その中に、アミノ酸配列の相同性からGluRδ1, δ2(= GluD1, D2)として位置付けられる遺伝子もクローニングされ、リガンドが不明でありチャネル活性は確認されないものの、1992年、1993年にそれぞれのサブユニットについて報告します2.3.。ラットの相同遺伝子は1993年にハイデルベルグ大学(当時)のP.H. Seeburg博士らのグループより報告されましたが、機能が未知であり三品グループのGluRδ1サブユニットの報告がわずかに先であったため、ラットにおいてもdelta-1, 2と命名されました4.。アミノ酸配列から推定されるリガンド結合領域や膜貫通領域などの各機能領域の構造から明らかにイオン透過型グルタミン酸受容体チャネルに分類されるものの、その後の十数年間、"グルタミン酸受容体"であるのかも"イオンチャネル"であるのかも解らないまま"孤児(orphan)受容体"のデルタ型グルタミン酸受容体と呼ばれることになります。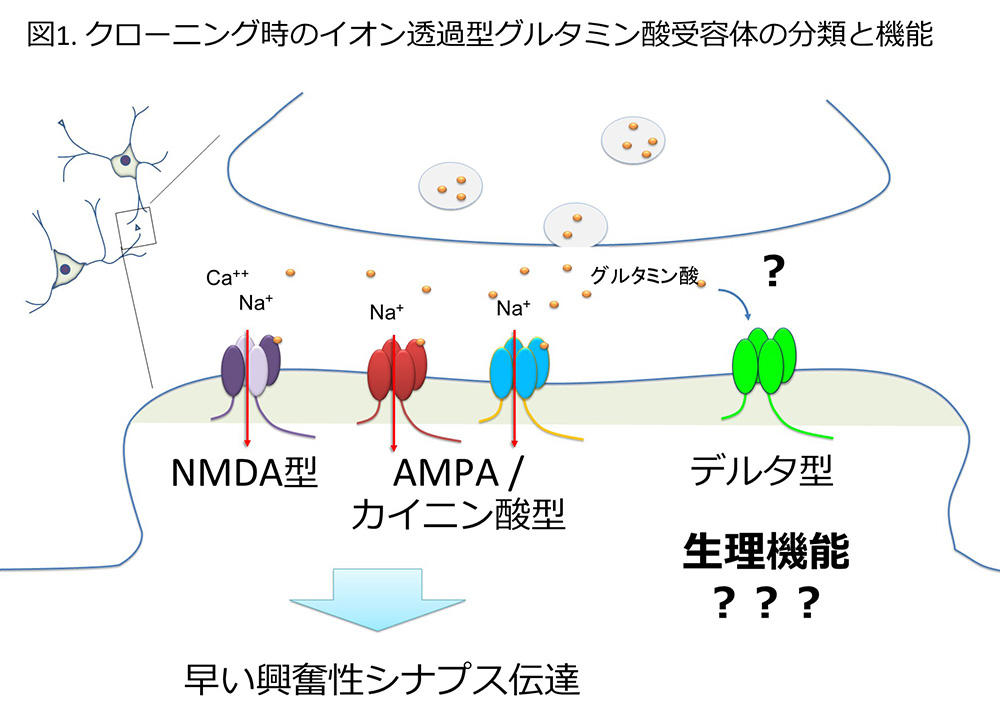
図1:遺伝子クローニングが行われていた当時、グルタミン酸受容体がNMDA型やAMPA/カイニン酸型というイオンチャネルに
分類されることは予想されていたが、デルタ型についてはリガンドも機能も不明であり、長い間"孤児受容体"と呼ばれていた。
デルタ型グルタミン酸受容体の生理機能① 各機能領域の担う役割
遺伝子発現様式について、GluD1サブユニットは成体では大脳皮質、海馬、小脳皮質を含む多くの脳領域や内耳の有毛細胞に豊富に発現していることが現在は知られていますが5.、クローニング当初には成体での発現量が少ないと予想されたためか長い間主要な研究対象として認識されませんでした。一方、GluD2サブユニットについては小脳プルキンエ細胞に極めて強く発現することが明らかとなっていました。そこで三品グループはその生理機能を明らかにするためノックアウト(KO)マウスを作製し、1995年、その生理機能の重要性を強く示唆する発見について報告します6.。このGluD2-KOマウスは重篤な運動失調という表現型を示し、電気生理学的にも、代表的なシナプス可塑性である平行線維-プルキンエ細胞シナプスにおける長期抑圧が障害されており、登上線維-プルキンエ細胞シナプスの精緻化の異常によりプルキンエ細胞の多重支配が生じていることが明らかとなりました。また形態学的にも正常な構造を持つ機能的なシナプス結合が激減していることが示されました。これらの異常は、GluD2サブユニットがプルキンエ細胞シナプスの形成、維持、機能に極めて重要な役割を果たしていることを示しています。
その後、GluD2-KOマウスのプルキンエ細胞に対し変異型GluD2サブユニットを発現させ表現型の変化を検証するなど、様々な解析により各機能領域の働きが明らかになってきました。平行線維-プルキンエ細胞シナプスにおいては、代謝型グルタミン酸受容体依存的なAMPA型グルタミン酸受容体チャネルの減少が長期抑圧の分子機序であることが知られていましたが、GluD2サブユニットの細胞内C末端領域に結合する分子の一つであるチロシン脱リン酸化酵素PTPMEGがGluA2サブユニットの細胞内領域のリン酸化状態を変化させることで間接的にこの長期抑圧を制御していることが明らかにされています7.。なお、デルフィリンという分子もGluD2サブユニットの細胞内C末端領域に結合し、デルフィリンのKOマウスでは長期抑圧が促進していることが示されていますが、GluD2サブユニットの機能との関連性は不明です8.。一方、細胞外N末端領域は、GluD2-KOマウスで生じる平行線維-プルキンエ細胞間のシナプス結合の異常を回復するのに十分な機能を有していることが示されました9.。また、リガンド結合領域にはD-セリンが結合することが明らかとなり、この結合はまた別の型の長期抑圧に必要であると考えられています10.。これら分子機序の解明については慶應大学医学部の柚崎通介教授らのグループの成果が大きく貢献しています。なお、クローニング当初より注目されていた"デルタ型グルタミン酸受容体はイオンチャネルとして機能するか"という問いについては現在も結論が出ていません。ラーチャーマウスというGluD2サブユニットの膜貫通領域に点変異が生じた突然変異マウスがいますが、このラーチャー変異が導入されたGluD2サブユニットは細胞内にイオンを流入させることが知られており、他のグルタミン酸受容体と同程度に膜貫通領域が進化的に保存されイオンチャネルとしての能力を有していると考えることができます11.12.。また、GluD2サブユニットに依存した電流が検出されるとの報告も少数ありますが、反証の余地もあり確定的では無いと考えられます13.。しかしながら、GluD2-KOマウスで生じる長期抑圧とシナプス結合の異常については、GluD2サブユニットの細胞内C末端領域と細胞外N末端領域の発現によりそれぞれを回復させるのに十分であることから、生理条件下でイオンチャネルとして機能するとしてもその意義については現時点では不明であると言えます。
デルタ型グルタミン酸受容体の生理機能② シナプスオーガナイザー
KOマウスの表現型より明らかとなったGluD2サブユニットの担う重要な生理機能の一つである"機能的なシナプス結合の形成と維持"に関連して、北海道大学医学部の渡辺雅彦教授らのグループによる形態学的解析により、生後のマウスにおけるGluD2サブユニットの欠損によっても平行線維-プルキンエ細胞シナプス数が減少し、プルキンエ細胞の樹状突起スパインに平行線維終末のシナプス結合が存在しない"フリースパイン"とシナプス前部と後部の構造にずれが生じた"ミスマッチシナプス"が出現することや、異常な登上線維シナプスが形成されること、GluD2-KOマウスではシナプス後部のAMPA型グルタミン酸受容体が増加することなどが明らかにされました14.-16.。ただしシナプス結合の形成に関連する分子機序については、細胞外N末端領域が重要であるということ以外の手がかりが得られない状況が長く続きましたが、思わぬ方向から解明への糸口が見出されます。セントジュード小児研究病院から慶應大学医学部に異動した柚崎らは、Cbln1という分子のKOマウスとGluD2-KOマウスの表現型が酷似していることを見出し、2005年に報告します17.。Cbln1~4からなるCblnファミリーはC1q/TNFスーパーファミリーに属する分泌性糖タンパクであり、Cbln1は平行線維を軸索とする小脳顆粒細胞に高発現することから、平行線維-プルキンエ細胞シナプスのスパインに局在するGluD2サブユニットの機能に関連していることが強く示唆されました。2010年、柚崎グループはGluD2サブユニットのリガンドとしてCbln1が直接結合し、このCbln1-GluD2複合体がシナプス前部と後部の双方向に作用して機能的なシナプス結合形成を誘導することのできる"シナプスオーガナイザー"であることを明らかにします18.。この発見により、ついにデルタ型グルタミン酸受容体から"孤児受容体"という肩書きが外れることになりました。ただし、その報告ではシナプス前部への作用の分子機序が明確では無かったのですが、約2ヶ月後に三品らのグループ(当時、東京大学)が別に進めていた研究結果を報告しました。その内容は、シナプス前部のニューレキシンという膜タンパクとCbln1-GluD2複合体が結合し、シナプス前部と後部を繋ぐ三者複合体を形成することで機能的シナプスを形成させるという発見でした19.。(同様の結果については、少し遅れて柚崎グループからも報告されます20.。)ニューレキシンはシナプス後部のニューロリギンという膜タンパクと結合する接着分子でシナプスオーガナイザーとして機能することも既に知られていたのですが、Cbln1-GluD2複合体もまたニューレキシンを介してシナプスオーガナイザーとして機能することが明らかとなったのです。
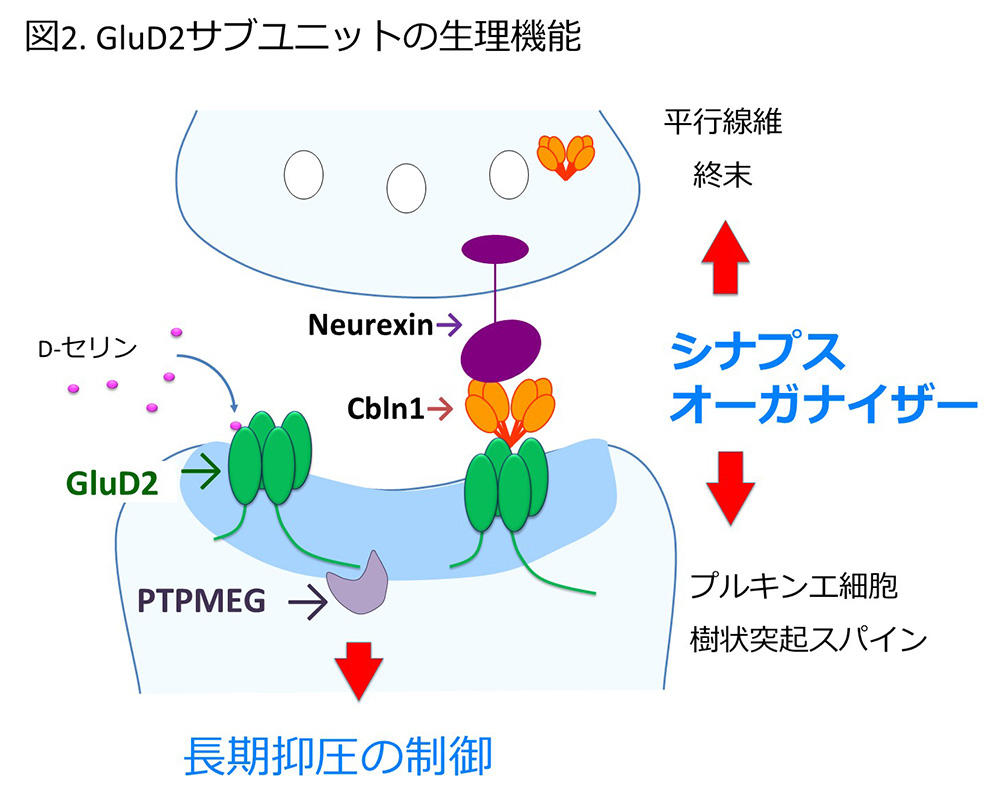
図2:GluD2サブユニットはニューレキシン( Neurexin )とCbln1と三者複合体を構成し、平行線維-プルキンエ細胞間のシナプス結合を形成させるシナプスオーガナイザーとして機能する。一方、 GluD2サブユニットの細胞外のリガンド結合領域にはD-セリンが結合し、細胞内C末端領域にはチロシン脱リン酸化酵素PTPMEGが結合して、長期抑圧に重要な役割を果たしている。
これらの発見から、GluD2サブユニットによる機能的なシナプス結合形成の分子機序の全体像が明らかになったと言えます。それまでは小脳皮質の平行線維-プルキンエ細胞シナプスにおける機能解析が中心となっていましたが、GluD2サブユニットとCblnファミリーは大脳皮質や海馬を含む広い領域で発現していることも知られており、現在では小脳皮質以外での生理機能も精力的に研究されています。さらにCbln1-GluD2の生理機能解明が契機となり、Cbln1と同じスーパーファミリーに属するC1ql1~4という分子もシナプス形成・維持・除去に重要な役割を果たしていることを、柚崎グループは次々と明らかにしてゆきます21.-23.。
デルタ型受容体と精神疾患
ヒトにおいてもGluD2サブユニットの欠損は小脳機能に関連する障害を引き起こしますが、同時に前頭側頭型認知症も生じるケースが報告されています24.-26.。また、精神疾患患者のゲノム解析よりヒトGluD2とデルタ型受容体と精神疾患との関連が指摘されています27.。一方、GluD1サブユニットについても統合失調症や自閉スペクトラム症との関連が報告されています28.29.。
GluD1サブユニットはクローニング当初ほとんど注目されていませんでしたが、GluD2サブユニットの生理機能が明らかになるに連れて研究が進んでいます。GluD1サブユニットもCblnファミリー、ニューレキシンとの複合体形成能を有しており、やはりシナプスオーガナイザーとして機能する可能性が示されています30.。GluD1-KOマウスは表現型としてうつ様行動、社会性などの異常を示し、シナプス関連分子の発現量の変化なども示すことが報告されました31.32.。最近、筆者らのグループもマウスの遺伝子背景をC57BL/6純系に統一し同腹仔コントロールをとることでGluD1-KOマウスを再評価し、デルタ型グルタミン酸受容体タンパクの詳細な発現脳領域、細胞内局在等について明らかにしつつ、GluD1サブユニットの欠損により生じるうつ様行動の変化が抗うつ薬の一種である選択的セロトニン再取り込み阻害薬により回復することを見出しました33.34.。また、デルタ型グルタミン酸受容体のリガンドであるCbln1の前脳特異的なKOマウスは学習試験で障害を示すことが明らかとなっています35.。ヒトの症例やゲノム解析結果と合わせて考えると、小脳における役割とは別に、デルタ型グルタミン酸受容体は脳の高次機能に重要な役割を果たしている可能性が強く示唆されます。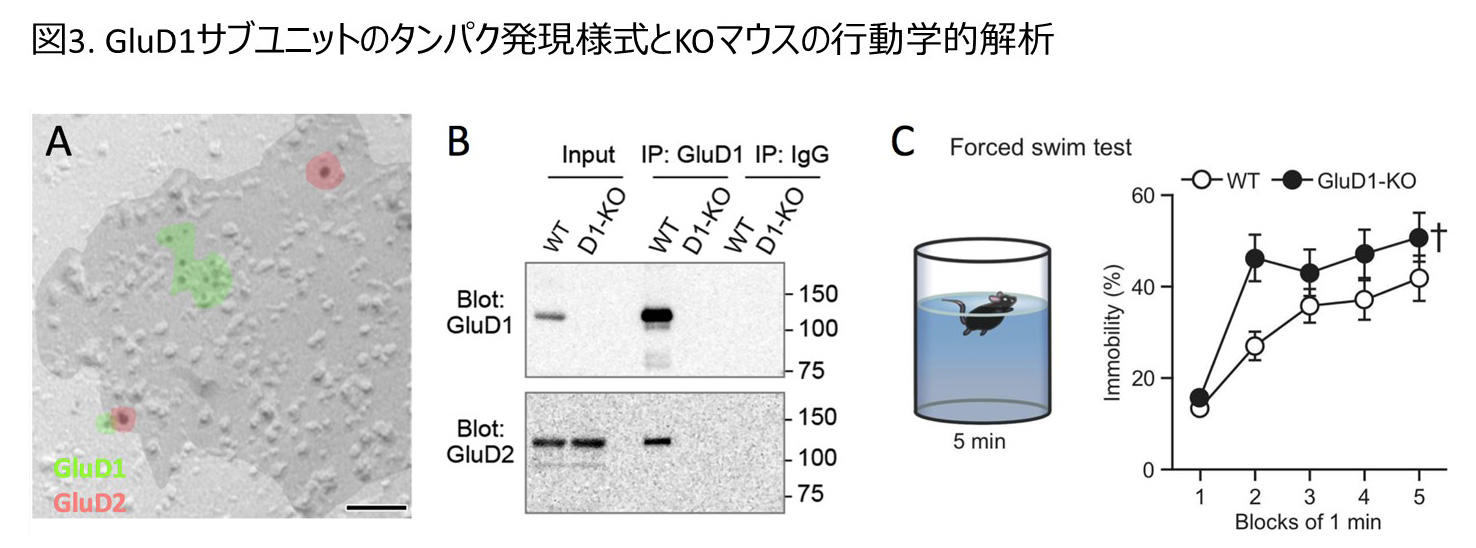
図3:(A)組織学的解析と(B)生化学的解析より明らかとなったポストシナプスでのデルタ型グルタミン酸受容体の局在様式。同一のシナプスにGluD1とGluD2の両方のサブユニットが存在し、免疫沈降法によりGluD1サブユニット抗体でGluD2サブユニットが共沈することが示された。(C)うつ様行動の指標となる強制水泳テストにおいてGluD1欠損マウスが示す無動時間の増加。この異常は抗うつ薬イミプラミンとフルオキセチンにより回復することが示された。(文献33, 34より改変)
終わりに
デルタ型グルタミン酸受容体について、その発見から生理機能解明の経緯を紹介させていただきました。遺伝子クローニング時代の研究者が次々と現役を引退されていく中、AMPA/カイニン酸型でもNMDA型でもないグルタミン酸受容体(でもない分子)が何故"デルタ型"と呼ばれているか、その理由が新潟大学脳研究所での発見にあったということを忘れ去られないようにという思いも込めて、分不相応ながら本コラムを執筆させていただきました。中心的役割とは言い難いですが、筆者もモデル動物作製を介していくつかの研究に関与し、続々と報告されてゆく新発見にリアルタイムで接することができたのは非常に幸運だったと感じています16.21.22.33.-35.。関係者の皆様には、事実誤認がありましたらご指摘をいただけるようお願い申し上げます。
本コラムは"記憶・学習に関与する分子群"というタイトルの予定でしたが、関連した内容で少し焦点を絞りましたのでタイトルを変更致しました。また、「脳の働きを分子から考える」というタイトルでコラムを連載してきましたが、当初に本連載を企画した担当者が退職されたため、勝手ながら今回をもちまして本連載を終了させていただきます。予定しておりました「ネズミの学習を測定する」「脳研究はどこに向かうか」については掲載できなかったことをお詫び申し上げます。
デンマーク・オーフス大DANDRITE研究所の中本千尋さんには、図の作成にご協力いただいたことを感謝致します。
文献
-
Hollmann M, Heinemann S: Cloned glutamate receptors. Annual review of neuroscience 1994, 17:31-108.
-
Yamazaki M, Araki K, Shibata A, Mishina M: Molecular cloning of a cDNA encoding a novel member of the mouse glutamate receptor channel family. Biochemical and biophysical research communications 1992, 183(2):886-892.
-
Araki K, Meguro H, Kushiya E, Takayama C, Inoue Y, Mishina M: Selective Expression of the Glutamate Receptor Channel δ2 Subunit in Cerebellar Purkinje Cells. Biochemical and biophysical research communications 1993, 197(3):1267-1276.
-
Lomeli H, Sprengel R, Laurie DJ, Köhr G, Herb A, Seeburg PH, Wisden W: The rat delta-1 and delta-2 subunits extend the excitatory amino acid receptor family. FEBS letters 1993, 315(3):318-322.
-
Konno K, Matsuda K, Nakamoto C, Uchigashima M, Miyazaki T, Yamasaki M, Sakimura K, Yuzaki M, Watanabe M: Enriched expression of GluD1 in higher brain regions and its involvement in parallel fiber-interneuron synapse formation in the cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience 2014, 34(22):7412-7424.
-
Kashiwabuchi N, Ikeda K, Araki K, Hirano T, Shibuki K, Takayama C, Inoue Y, Kutsuwada T, Yagi T, Kang Y et al: Impairment of motor coordination, Purkinje cell synapse formation, and cerebellar long-term depression in GluR delta 2 mutant mice. Cell 1995, 81(2):245-252.
-
Kohda K, Kakegawa W, Matsuda S, Yamamoto T, Hirano H, Yuzaki M: The δ2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites. Proceedings of the National Academy of Sciences 2013, 110(10):E948-E957.
-
Takeuchi T, Ohtsuki G, Yoshida T, Fukaya M, Wainai T, Yamashita M, Yamazaki Y, Mori H, Sakimura K, Kawamoto S et al: Enhancement of both long-term depression induction and optokinetic response adaptation in mice lacking delphilin. PloS one 2008, 3(5):e2297.
-
Kakegawa W, Miyazaki T, Kohda K, Matsuda K, Emi K, Motohashi J, Watanabe M, Yuzaki M: The N-terminal domain of GluD2 (GluRdelta2) recruits presynaptic terminals and regulates synaptogenesis in the cerebellum in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience 2009, 29(18):5738-5748.
-
Kakegawa W, Miyoshi Y, Hamase K, Matsuda S, Matsuda K, Kohda K, Emi K, Motohashi J, Konno R, Zaitsu K et al: D-serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor. Nature neuroscience 2011, 14(5):603-611.
-
Kohda K, Wang Y, Yuzaki M: Mutation of a glutamate receptor motif reveals its role in gating and delta2 receptor channel properties. Nature neuroscience 2000, 3(4):315-322.
-
Ikeno K, Yamakura T, Yamazaki M, Sakimura K: The Lurcher mutation reveals Ca(2+) permeability and PKC modification of the GluRdelta channels. Neuroscience research 2001, 41(2):193-200.
-
Ady V, Perroy J, Tricoire L, Piochon C, Dadak S, Chen X, Dusart I, Fagni L, Lambolez B, Levenes C: Type 1 metabotropic glutamate receptors (mGlu1) trigger the gating of GluD2 delta glutamate receptors. EMBO reports 2014, 15(1):103-109.
-
Takeuchi T, Miyazaki T, Watanabe M, Mori H, Sakimura K, Mishina M: Control of synaptic connection by glutamate receptor delta2 in the adult cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience 2005, 25(8):2146-2156.
-
Miyazaki T, Yamasaki M, Takeuchi T, Sakimura K, Mishina M, Watanabe M: Ablation of glutamate receptor GluRδ2 in adult Purkinje cells causes multiple innervation of climbing fibers by inducing aberrant invasion to parallel fiber innervation territory. The Journal of neuroscience : the official journal of the Society for Neuroscience 2010, 30(45):15196-15209.
-
Yamasaki M, Miyazaki T, Azechi H, Abe M, Natsume R, Hagiwara T, Aiba A, Mishina M, Sakimura K, Watanabe M: Glutamate receptor delta2 is essential for input pathway-dependent regulation of synaptic AMPAR contents in cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience 2011, 31(9):3362-3374.
-
Hirai H, Pang Z, Bao D, Miyazaki T, Li L, Miura E, Parris J, Rong Y, Watanabe M, Yuzaki M et al: Cbln1 is essential for synaptic integrity and plasticity in the cerebellum. Nature neuroscience 2005, 8(11):1534-1541.
-
Matsuda K, Miura E, Miyazaki T, Kakegawa W, Emi K, Narumi S, Fukazawa Y, Ito-Ishida A, Kondo T, Shigemoto R et al: Cbln1 is a ligand for an orphan glutamate receptor delta2, a bidirectional synapse organizer. Science (New York, NY) 2010, 328(5976):363-368.
-
Uemura T, Lee SJ, Yasumura M, Takeuchi T, Yoshida T, Ra M, Taguchi R, Sakimura K, Mishina M: Trans-synaptic interaction of GluRdelta2 and Neurexin through Cbln1 mediates synapse formation in the cerebellum. Cell 2010, 141(6):1068-1079.
-
Matsuda K, Yuzaki M: Cbln family proteins promote synapse formation by regulating distinct neurexin signaling pathways in various brain regions. The European journal of neuroscience 2011, 33(8):1447-1461.
-
Kakegawa W, Mitakidis N, Miura E, Abe M, Matsuda K, Takeo YH, Kohda K, Motohashi J, Takahashi A, Nagao S et al: Anterograde C1ql1 signaling is required in order to determine and maintain a single-winner climbing fiber in the mouse cerebellum. Neuron 2015, 85(2):316-329.
-
Matsuda K, Budisantoso T, Mitakidis N, Sugaya Y, Miura E, Kakegawa W, Yamasaki M, Konno K, Uchigashima M, Abe M et al: Transsynaptic Modulation of Kainate Receptor Functions by C1q-like Proteins. Neuron 2016, 90(4):752-767.
-
Yuzaki M: The C1q complement family of synaptic organizers: not just complementary. Current Opinion in Neurobiology 2017, 45:9-15.
-
Utine GE, Haliloğlu G, Salancı B, Çetinkaya A, Kiper PÖ, Alanay Y, Aktaş D, Boduroğlu K, Alikaşifoğlu M: A Homozygous Deletion in GRID2 Causes a Human Phenotype With Cerebellar Ataxia and Atrophy. Journal of Child Neurology 2013, 28(7):926-932.
-
Hills LB, Masri A, Konno K, Kakegawa W, Lam AT, Lim-Melia E, Chandy N, Hill RS, Partlow JN, Al-Saffar M et al: Deletions in GRID2 lead to a recessive syndrome of cerebellar ataxia and tonic upgaze in humans. Neurology 2013, 81(16):1378-1386.
-
Maier A, Klopocki E, Horn D, Tzschach A, Holm T, Meyer R, Meyer T: De novo partial deletion in GRID2 presenting with complicated spastic paraplegia. Muscle & Nerve 2014, 49(2):289-292.
-
Strehle E-M, Yu L, Rosenfeld JA, Donkervoort S, Zhou Y, Chen T-J, Martinez JE, Fan Y-S, Barbouth D, Zhu H et al: Genotype-phenotype analysis of 4q deletion syndrome: Proposal of a critical region. American Journal of Medical Genetics Part A 2012, 158A(9):2139-2151.
-
Nenadic I, Maitra R, Scherpiet S, Gaser C, Schultz CC, Schachtzabel C, Smesny S, Reichenbach JR, Treutlein J, Mühleisen TW et al: Glutamate receptor delta 1 (GRID1) genetic variation and brain structure in schizophrenia. Journal of Psychiatric Research 2012, 46(12):1531-1539.
-
Griswold AJ, Ma D, Cukier HN, Nations LD, Schmidt MA, Chung RH, Jaworski JM, Salyakina D, Konidari I, Whitehead PL et al: Evaluation of copy number variations reveals novel candidate genes in autism spectrum disorder-associated pathways. Human molecular genetics 2012, 21(15):3513-3523.
-
Tao W, Díaz-Alonso J, Sheng N, Nicoll RA: Postsynaptic δ1 glutamate receptor assembles and maintains hippocampal synapses via Cbln2 and neurexin. Proceedings of the National Academy of Sciences 2018, 115(23):E5373-E5381.
-
Yadav R, Gupta SC, Hillman BG, Bhatt JM, Stairs DJ, Dravid SM: Deletion of Glutamate Delta-1 Receptor in Mouse Leads to Aberrant Emotional and Social Behaviors. PloS one 2012, 7(3):e32969.
-
Yadav R, Hillman BG, Gupta SC, Suryavanshi P, Bhatt JM, Pavuluri R, Stairs DJ, Dravid SM: Deletion of Glutamate Delta-1 Receptor in Mouse Leads to Enhanced Working Memory and Deficit in Fear Conditioning. PloS one 2013, 8(4):e60785.
-
Nakamoto C, Konno K, Miyazaki T, Nakatsukasa E, Natsume R, Abe M, Kawamura M, Fukazawa Y, Shigemoto R, Yamasaki M et al: Expression mapping, quantification, and complex formation of GluD1 and GluD2 glutamate receptors in adult mouse brain. The Journal of comparative neurology 2020, 528(6):1003-1027.
-
Nakamoto C, Kawamura M, Nakatsukasa E, Natsume R, Takao K, Watanabe M, Abe M, Takeuchi T, Sakimura K: GluD1 knockout mice with a pure C57BL/6N background show impaired fear memory, social interaction, and enhanced depressive-like behavior. PloS one 2020, 15(2):e0229288.
-
Otsuka S, Konno K, Abe M, Motohashi J, Kohda K, Sakimura K, Watanabe M, Yuzaki M: Roles of Cbln1 in Non-Motor Functions of Mice. The Journal of neuroscience : the official journal of the Society for Neuroscience 2016, 36(46):11801-11816.





